Caso clínico de Anestesia
A. Cañón, J. Viscasillas, M.R. Marti-Scharhausen, J.I. Redondo, E.Z. Hernández, A. Martínez
Contacto: arielcanonp@gmail.com
Historia clínica
Se diseñó un protocolo anestésico para un perro de raza bichón maltés, macho, castrado de 11 años y 5,15 kg en el que se iba a realizar una tiroidectomía derecha por diagnóstico presuntivo de carcinoma tiroideo. El animal era asintomático y la evaluación preanestésica, consistente en examen físico, las pruebas de imagen realizadas previamente (Fig. 1), la analítica sanguínea (incluida determinación de hormonas tiroideas y TSH) y el electrocardiograma no mostraron alteraciones. Por todo ello, el animal fue clasificado como ASA II.
Figura 1
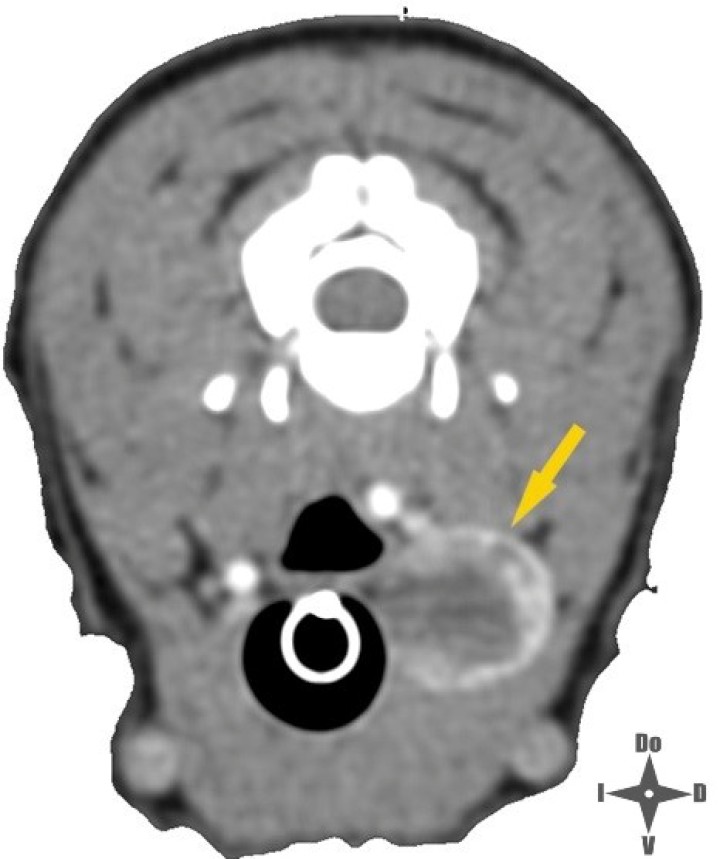
Imagen de TC con contraste IV; la fecha amarilla señala la neoplasia.
¿Qué consideraciones anestésicas referidas a dicha patología deben tenerse en cuenta?
Las neoplasias tiroideas representan aproximadamente entre el 1,2 y el 3,8 % de las neoplasias caninas,1 siendo los carcinomas más comunes que los adenomas. Los carcinomas tiroideos se caracterizan por su rápido crecimiento y es probable su invasión a tejidos adyacentes como laringe, tráquea, arteria carótida o vena yugular, entre otras estructuras, lo cual es parte de la pesquisa previa para establecer el estadío de la neoplasia.2 En el presente caso se realizó previamente una tomografía computarizada (TC) en la que se observó que el tamaño de la neoplasia era de 1,6 x 1,5 x 2,5 centímetros. Seguidamente, se inyectó contraste intravenoso para evaluar el comportamiento invasivo de la neoplasia, no observándose invasión aparente hacia los tejidos adyacentes como tampoco signos de metástasis pulmonar.
Durante el procedimiento quirúrgico para su extirpación puede haber afectación del nervio laríngeo recurrente, lo que puede llevar a parálisis laríngea postquirúrgica, así como también a la aparición de síndrome de Horner por lesión de fibras simpáticas. Otra complicación referida al procedimiento quirúrgico es la hemorragia tanto intra como postquirúrgica. Además de considerarse la administración de hemoderivados, esta hemorragia podría generar obstrucción de la vía aérea debido al hematoma que puede formarse.3
También es importante diferenciar si se trata de neoplasia funcional o afuncional, siendo en perros infrecuente la presencia de neoplasias funcionales, a diferencia de lo que sucede en gatos. En el presente caso los niveles de hormonas tiroideas fueron normales y el paciente era totalmente asintomático. Aun así, debe considerarse la posibilidad de aparición de signos clínicos (como, por ejemplo, arritmias cardiacas, hipertensión, hipertermia, jadeo, paro cardiaco) relacionados con efectos directos de la elevación súbita de hormonas tiroideas, pudiendo inclusive generarse una condición de tirotoxicosis aguda que amenace la vida del paciente.
Con la extirpación conjunta de la glándula tiroides y la paratiroides, la hipocalcemia postoperatoria puede ser una complicación grave, por lo que la calcemia debe ser monitorizada y regulada durante el periodo postoperatorio. Sin embargo esta complicación es menos probable si la afectación es unilateral.
¿Qué protocolo anestésico emplearía?
La anestesia libre de opioides (ALO) es una alternativa respaldada tanto por publicaciones en medicina veterinaria4,5 como por una amplia bibliografía en medicina humana, y la anestesia locorregional es una herramienta sumamente útil para alcanzar sus objetivos. Prescindir del uso de opioides permite evitar sus potenciales efectos secundarios (depresión respiratoria y cardiaca, náuseas y vómitos postoperatorios, entre otros).4,6
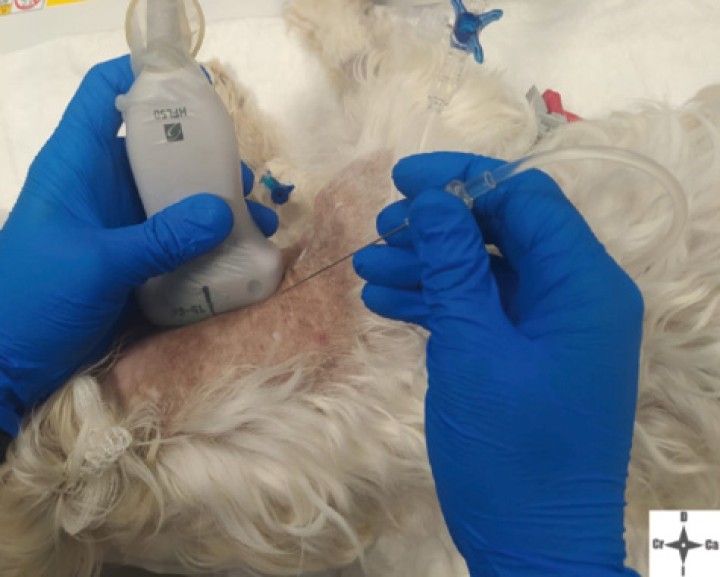
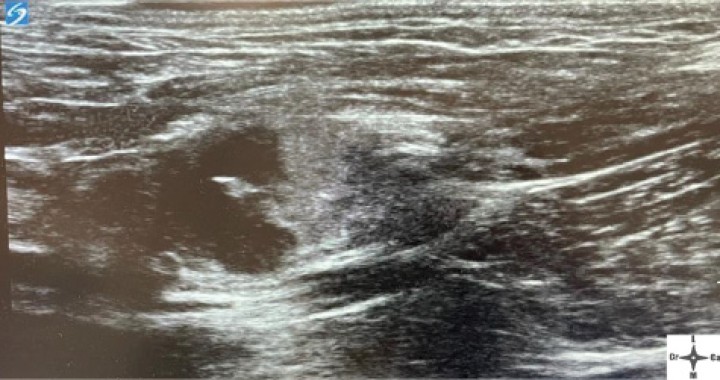
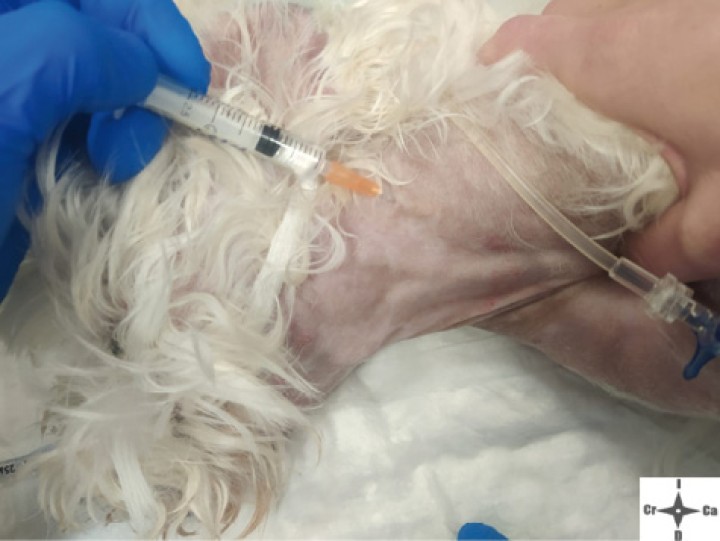
Con el fin de evitar el uso de opioides, se planificó una ALO cuya premedicación consistió en dexmedetomidina (Dexmopet, Fatro, Barcelona) 8 µg/kg vía intramuscular, considerando el carácter nervioso y excitable del paciente. A los 15 minutos se canalizó la vena cefálica (Sterican 22G x 1, BBraun vetcare, Barcelona), previa preoxigenación, y la anestesia se indujo con 3,5 mg/kg de propofol intravenoso (IV) (Propofol Lipuro, BBraun Vetcare, Barcelona). El mantenimiento anestésico se realizó con sevoflurano (SevoFlo, Zoetis, Louvain-la-Neuve) (concentración de sevoflurano espirada entre 1,7-2,0) empleando una FiO2 de 0,5 y ventilación espontánea. Se monitorizó la pulsioximetría, temperatura, ECG, capnografía, presión arterial no invasiva (PANI) y espirometría mediante un monitor multiparamétrico (5S Datex-Ohmeda, Finlandia). Se planeó realizar una TC prequirúrgica para volver a valorar la masa antes de comenzar la cirugía. Aprovechando esta circunstancia, se colocó al paciente en decúbito lateral izquierdo, depilando la región cervical, y se procedió a realizar un bloqueo anestésico ecoguiado empleando un ecógrafo portátil (Sonosite M-turbo, Sonosite, EUA) con sonda lineal 10-15 MHz posicionada inmediatamente ventral al ala del atlas en sentido longitudinal a la columna cervical (Figs. 2 y 3). Se localizaron las raíces ventrales cervicales de C2 y C3, las cuales se visualizan en el plano interfascial entre los músculos omotransverso e intertransversos, como engrosamientos de este, siendo dichas raíces estructuras elipsoidales con un halo hiperecoico y su centro hipoecoico. La neoplasia se encontraba próxima al sitio de inyección (Fig. 4). Se realizó un abordaje en plano y se inyectó una mezcla de bupivacaína (Bupivacaine, BBraun, Barcelona) 0,5 % con contraste iodado (Ultravist 300, Berlimed S.A, Alcalá de Henares) en una proporción de 4:1, a razón de 0,15 ml/kg alrededor del espacio interfascial de C2, confirmando la hidrodisección de este plano (Fig. 4). Además, se realizó la inyección contralateral subcutánea en las ramas ventrales superficiales de C2, que se localizan anatómicamente aproximadamente entre 0,5 y 1 cm dorsal a la bifurcación de la vena yugular en la grasa subcutánea profunda al platisma, utilizando 0,1 ml/kg de bupivacaína 0,5 % (Fig. 5). Dichos bloqueos se realizaron tras un exhaustivo estudio de la anatomía de la región, el reconocimiento cadavérico de dichas estructuras y empleando como referencia tanto el bloqueo descrito en equinos como el bloqueo intermedio del plexo cervical descrito en humanos. Se utilizó una aguja espinal (Spinocan Quincke 22 gauge, BBraun, Barcelona). Una vez realizado el bloqueo se repitió inmediatamente otra TC para evaluar la distribución de la solución inyectada (Figs. 6 y 7).
Figura 2
Posicionamiento de la sonda ecográfica.
Figura 3
Abordaje en plano para realizar el bloqueo.
Figura 4
Ventana acústica observando la neoplasia cavitada previamente a la inyección del anestésico local con contraste iodado.
Figura 5
Ventana acústica observando la neoplasia cavitada y la distribución del volumen inyectado (AL).
Figura 6
Inyección contralateral subcutánea de ramas superficiales de C2.
Figura 7
Imágenes de TC post-inyección. (A) Corte sagital. (B) Corte axial. La flecha amarilla marca la neoplasia y las cabezas de flecha rojas el contraste en el espacio interfascial.
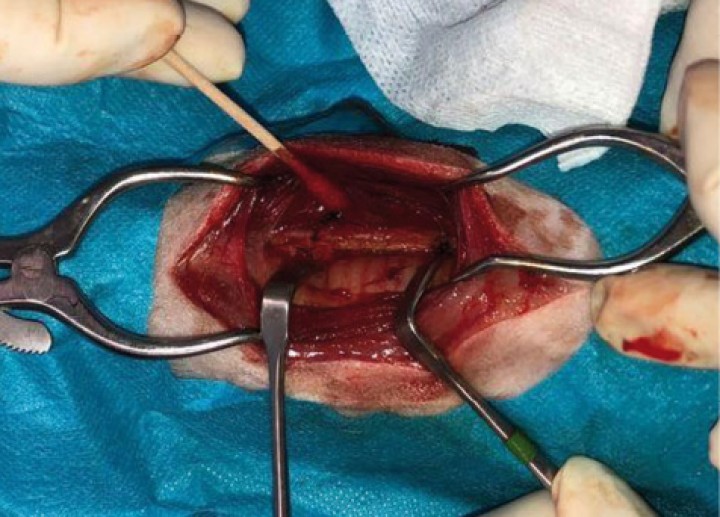
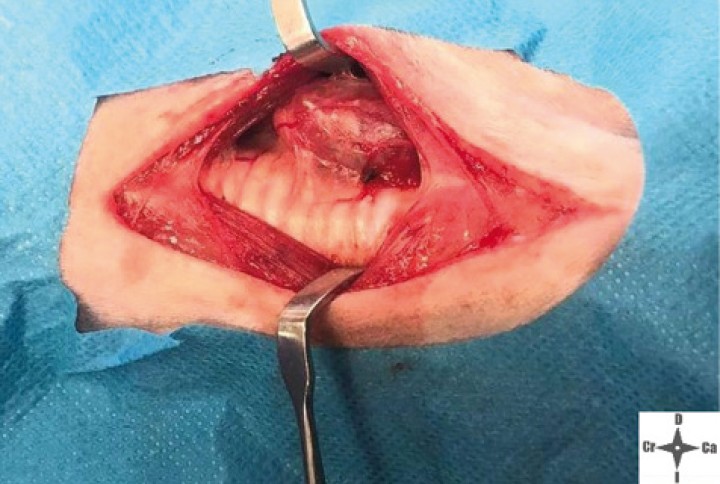
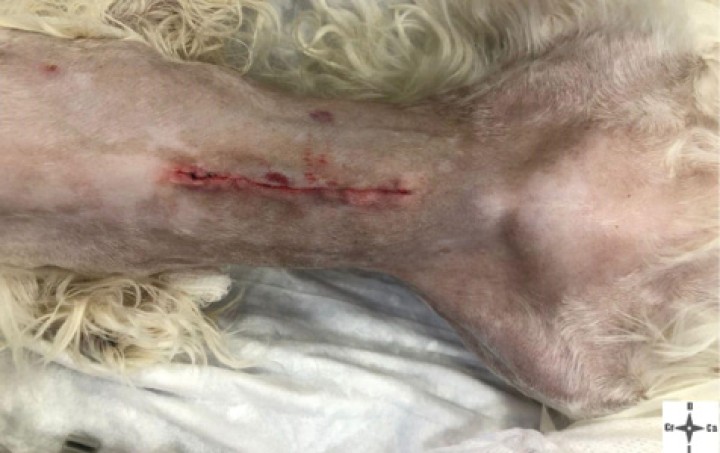
Al inicio de la cirugía (Figs. 8 y 9), durante la incisión de piel, se produjo una respuesta nociceptiva observándose una elevación de la PANI y la frecuencia respiratoria (FR) (<15 % de aumento de los valores anteriores), que se estabilizaron sin necesidad de rescate analgésico. Durante el resto de la cirugía, los parámetros se mantuvieron con variaciones mínimas dentro de los márgenes fisiológicos. Al finalizar el procedimiento, se administró meloxicam a 0,2 mg/kg IV (Metacam, Boehringer Ingelheim, Terrassa) y, considerando el carácter nervioso del paciente, dexmedetomidina a 1 µg/kg IV lento. Tras esto se procedió a la extubación de la tráquea del animal y su recuperación fue buena y sin complicaciones. La duración total del procedimiento desde la intubación hasta la extubación fue de 2,5 horas (Fig. 10).
Figura 8
Abordaje quirúrgico de la región previa a exponer la neoplasia.
Figura 9
Imagen de la neoplasia durante el abordaje quirúrgico.
Figura 10
Área quirúrgica una vez finalizado el procedimiento quirúrgico.
Se transfirió el paciente a hospitalización, donde se continuó su monitorización y se elaboró un plan analgésico conjunto.
¿Cómo plantearía el manejo del dolor postquirúrgico?
En hospitalización se pautó la valoración de dolor mediante la escala de Glasgow modificada comenzando a las 4 horas del bloqueo y obteniendo un valor de 2/24, el cual una hora más tarde fue de 3/24. Se inició terapia con paracetamol (Paracetamol B. Braun, BBraun, Barcelona) a dosis de 10 mg/kg IV TID durante 36 horas. En caso de requerir rescate analgésico al superar el umbral de intervención en la escala de Glasgow se pautó buprenorfina, la cual no fue necesario administrar. Se continuó evaluando el dolor y se registraron valores de 2/24 en todas las mediciones.
El animal presentó apetito y comió dieta blanda a las 6 horas postextubación, tolerando correctamente la ingesta. La administración oral de meloxicam se continuó a 0,1 mg/kg SID durante 4 días totales. A las 36 horas se dio el alta hospitalaria debido a su buena evolución, asistiendo a posteriores controles refiriendo muy buena evolución.
Discusión
En este caso fue posible evitar el uso de opioides tanto durante la cirugía como también durante la hospitalización. El manejo analgésico empleando el bloqueo ecoguiado de las raíces cervicales C2-C3 sumado a la analgesia aportada por la dexmedetomidina fue satisfactorio durante el periodo intraquirúrgico. Esto permitió no solo evitar el uso de opioides sino de otros fármacos analgésicos sistémicos y mantener una concentración espirada de sevoflurano inferior a su concentración alveolar mínima (CAM) en perro, por lo que la recuperación anestésica fue rápida. Los valores bajos encontrados en la escala de Glasgow nos indican que el tratamiento postoperatorio utilizado también fue eficaz para controlar el dolor en esta fase.
La anestesia locorregional ecoguiada ocupa un lugar cada vez más importante en la anestesia veterinaria. El desarrollo continuo de nuevas técnicas y abordajes permite tener múltiples alternativas, observándose en los últimos años un auge de los bloqueos interfasciales. En medicina humana existe sobrada experiencia y abundantes publicaciones sobre la utilización de bloqueos del plexo cervical, con sus diferentes abordajes (como son el superficial, intermedio y profundo), para múltiples procedimientos a nivel cervical, que involucran piel, ganglios, glándulas tiroides y/o paratiroides, e incluso aquellos sobre la arteria carótida; inclusive se reporta la cirugía de glándula tiroides bajo anestesia local solamente.7 En veterinaria no contamos actualmente con dicha información; recientemente se ha publicado la utilización de este bloqueo en un perro para cirugía de lateralización de aritenoides8 y la descripción en equinos de un bloqueo similar (para la raíz de C2) utilizado también para cirugía de lateralización de aritenoides.9 La importancia del bloqueo de las ramas ventrales de C2 se debe a que de ella se originan el nervio Auricular Mayor que inerva la región parotídea, base del oído externo y piel de cara convexa del pabellón auricular; y el nervio Cervical Transverso que proporciona ramas al platisma, la región laríngea e intermandibular. Entre ellos existen áreas de superposición en la inervación. El nervio C3 aparece a lo largo del músculo omotransverso, junto con las ramas ventrales de C4 y C5 que inervan músculos hipoaxiales y piel de regiones laterales y ventrales de cuello, siendo el C3 responsable de la inervación de la mitad proximal del cuello. El bloqueo contralateral subcutáneo es un abordaje que puede realizarse por referencias anatómicas para bloquear las ramas superficiales que inervan los dermatomos de la región faríngea y laríngea, que en nuestro caso se realizó con el fin de insensibilizar la inervación contralateral que pudiera superponerse a la zona de incisión.
La utilización de ecografía en la anestesia locorregional no solo permite incrementar la tasa de éxito de los bloqueos, sino también disminuir los riesgos asociados a los mismos. En nuestro paciente fue posible observar mediante ecografía el espacio interfascial donde debíamos colocar el anestésico local, a pesar de tener la masa en esa zona, con la posibilidad de evaluar posteriormente su distribución mediante la TC.
El aumento de la PANI y FR durante la incisión de piel puede explicarse por la superposición compleja de la inervación de los dermatomos cervicales,10 y porque nuestro bloqueo superficial contralateral solo insensibiliza C2, pero no así C3 que podría bloquearse mediante otra inyección de anestésico local en la región de su proyección anatómica. Otro motivo del aumento de parámetros podría deberse al plano anestésico superficial que se evaluó por la concentración espirada de sevoflurano, la cual se encontraba por debajo de la CAM, siendo el reflejo palpebral negativo y el tono mandibular nulo.
Como todo bloqueo anestésico, el utilizado en este paciente no estaba exento de complicaciones: además de las complicaciones comunes a todos los bloqueos (punción intravascular, sangrado, reacciones anafilácticas, lesión nerviosa, etc.), podrían considerarse los particulares a nuestra técnica como pueden ser migración hacia sistema nervioso central, que pudo descartarse gracias a las imágenes de TC, o el bloqueo del nervio frénico. Esta complicación ha sido reportada en medicina humana pero, dado que en caninos dicho nervio se origina de raíces ventrales de C5-C7, con contribuciones inconstantes de C4, el riesgo de bloquear el nervio frénico es, por tanto, menor que en humanos (donde se origina de C3-C4 con contribución inconstante de C5). Potencialmente también podrían aparecer signos como consecuencia del bloqueo a nivel vagosimpático, pudiendo observarse síndrome de Horner, o parálisis laríngea, que como comentamos anteriormente son complicaciones potenciales del procedimiento quirúrgico, y que en nuestro caso no se registraron.
La utilización del bloqueo del plexo cervical permitió en este caso reducir el uso de opioides durante la cirugía y el postoperatorio. De todas formas, se necesitan más estudios para conocer el alcance analgésico de este bloqueo anestésico y sus potenciales complicaciones.
Fuente de financiación: para el presente trabajo no se ha contado con fuente de financiación privada ni pública.
Conflicto de interés: los autores declaran no poseer conflicto de interés.
Bibliografía
- 1.
Liptak JM: Canine thyroid carcinoma. Clin Tech Small Anim Pract. 2007; 22(2): 75-81.
[pubMed] - 2.
Prastiti E, Tzenetidou Z, Papazoglou, LG: Canine thyroid tumours: diagnosis and treatment. Hellenic Journal of Companion Animal Medicine 2018; 7(2): 8-27.
- 3.
Reagan JK, Selmic LE, Fallon C. et al: Complications and outcomes associated with unilateral thyroidectomy in dogs with naturally occurring thyroid tumors: 156 cases (2003–2015). J Am Vet Med Assoc 2019; 255(8): 926-932.
[pubMed] - 4.
White DM, Mair AR, Martinez-Taboada F: Opioid-free anaesthesia in three dogs. Open Vet J 2017; 7(2): 104-110.
[pubMed] - 5.
Geddess, AT, Stathopoulou T, Viscasillas J, Lafuente P: Opioid-free anaesthesia (OFA) in a springer spaniel sustaining a lateral humeral condylar fracture undergoing surgical repair. Vet Rec Case Rep 2019; 7:1.
- 6.
Bohringer C, Astorga C, Liu H: The Benefits of Opioid Free Anesthesia and the Precautions Necessary When Employing It. Transl Perioper Pain Med 2020; 7(1): 152-157.
[pubMed] - 7.
Guerin JP, Theissen A, Ley-Ghiglione L, et al.: Bloqueo del plexo cervical. EMC-Anestesia-Reanimación 2017; 43(2): 1-8.
- 8.
Cañón A, Viscasillas J, Hernández EZ et al: Line block and ultrasound-guided C2-C3 ventral branch block in a dog undergoing left arytenoid lateralization. Vet Anaesth Analg 2022 Jun 7:S1467-2987(22)00095-2.
[pubMed] - 9.
Campoy L, Morris T, Ducharme N, Gleed R, Martin-Flores M: Unilateral cervical plexus block for prosthetic laryngoplasty in the standing horse. Equine Vet J 2018; 50(6): 727-732.
[pubMed] - 10.
Whalen L.R, Kitchell R.L: Electrophysiologic studies of the cutaneous nerves of the head of the dog. Am J Vet Res 1983; 44(4): 615-624.
[pubMed]