Aneurisma de la aurícula derecha diagnosticado por tomografía computarizada en un perro geriátrico
Right atrial appendage aneurysm diagnosed by computed tomography in a geriatric dog
A. Carrión, P.M. Cortés, B. Mena, N. Vallés, A. Agut
Contacto: angelescarrion@vetocardia.com
Resumen
Se presenta una perra mestiza castrada de 13 años con intolerancia al ejercicio que presenta soplo y pulso de intensidad variable en el examen físico. Dentro del protocolo diagnóstico se realizan radiografías torácicas, ecocardiografía y electrocardiograma. En las radiografías del tórax se identificó una opacidad tejido blando a nivel de mediastino craneoventral. En la ecocardiografía, además de diagnosticarse enfermedad degenerativa de la válvula mitral, se evidenció una estructura de pared fina y contenido anecógeno adyacente al atrio derecho. En el electrocardiograma se observaron complejos prematuros atriales frecuentes (ritmo bigémino). Se realizó una angio-tomografía computarizada y se diagnosticó un aneurisma de aurícula derecha. En conclusión, los aneurismas de aurícula derecha, aunque son una patología rara, deben incluirse en el diagnóstico diferencial de posibles masas en mediastino craneoventral.
Palabras clave: aneurisma, atrio derecho, aurícula derecha, masa mediastino.
Clin Vet Peq Anim 2023, 43 (3): 163-168
Summary
A 13-year-old spayed female dog is presented with exercise intolerance. The physical examination revealed a heart murmur and differences in pulse pressure. Thoracic radiographs, echocardiography, and electrocardiography were performed. On the radiographs, a soft tissue opacity was observed at the level of the cranioventral mediastinum. Echocardiography revealed mitral valve disease and a thin-walled structure with anechoic content adjacent to the right atrium. On the electrocardiogram, frequent atrial premature complexes (bigeminy) were observed. Angio-Computed Tomography was performed, and a right atrial appendage aneurysm was diagnosed. In conclusion, although right atrial appendage aneurysms are a rare condition, they should be taken into account in the differential diagnosis when a possible soft tissue mass in the cranioventral mediastinum is observed in a dog.
Keywords: aneurysm, right atrium, right atrial appendage, mediastinal mass.
Clin Vet Peq Anim 2023, 43 (3): 163-168

La presencia de este logo en un artículo de la revista indica que se publicará un examen sobre el mismo en la plataforma AVEPA Elearning. Su resolución aporta 0,15 créditos dentro del sistema de acreditaciones de especialidades veterinarias de AVEPA.
Introducción
Los aneurismas de la aurícula derecha (AAD) son lesiones cardiacas poco comunes tanto en el perro como en humanos.1-10 Consisten en una dilatación de la aurícula derecha que puede estar o no asociada a un defecto pericárdico.3,4 La etiología más frecuente es congénita,1 pero también existen causas adquiridas.2 Pueden ser sintomáticos, generalmente debido a la asociación de arritmias supraventriculares,2,4,5 aunque muchos de los casos descritos en la literatura veterinaria se han encontrado como hallazgos incidentales al realizar pruebas de imagen.1-3,7
El objetivo de este trabajo es describir un caso de una perra de 13 años con AAD diagnosticado mediante angio-tomografía computarizada (TC) y los hallazgos del examen clínico, electrocardiograma y otras pruebas de imagen (radiografía y ecocardiografía).
Caso clínico
Se presenta una perra esterilizada de 13 años, raza Chihuahua y 4 kg de peso con condición corporal 6/9 y estado mental alerta, con una historia de 2 meses de disminución de la actividad y leve intolerancia al ejercicio. Se realiza una analítica sanguínea y los resultados de la hematología y bioquímica sérica se encontraban dentro de los valores de referencia. En la exploración física las mucosas eran rosadas con tiempo de relleno capilar menor de 2 segundos, la frecuencia respiratoria fue de 20 rpm. La auscultación cardiaca reveló presencia de soplo sistólico apical izquierdo grado IV/VI con ritmo irregular por la posible presencia de latidos ectópicos y frecuencia cardiaca de 100 lpm. Se detectó presión de pulso variable (fuerte-débil) en relación 1:1, siendo el pulso sincrónico e igual entre ambas extremidades. El resto de la exploración física fue normal.
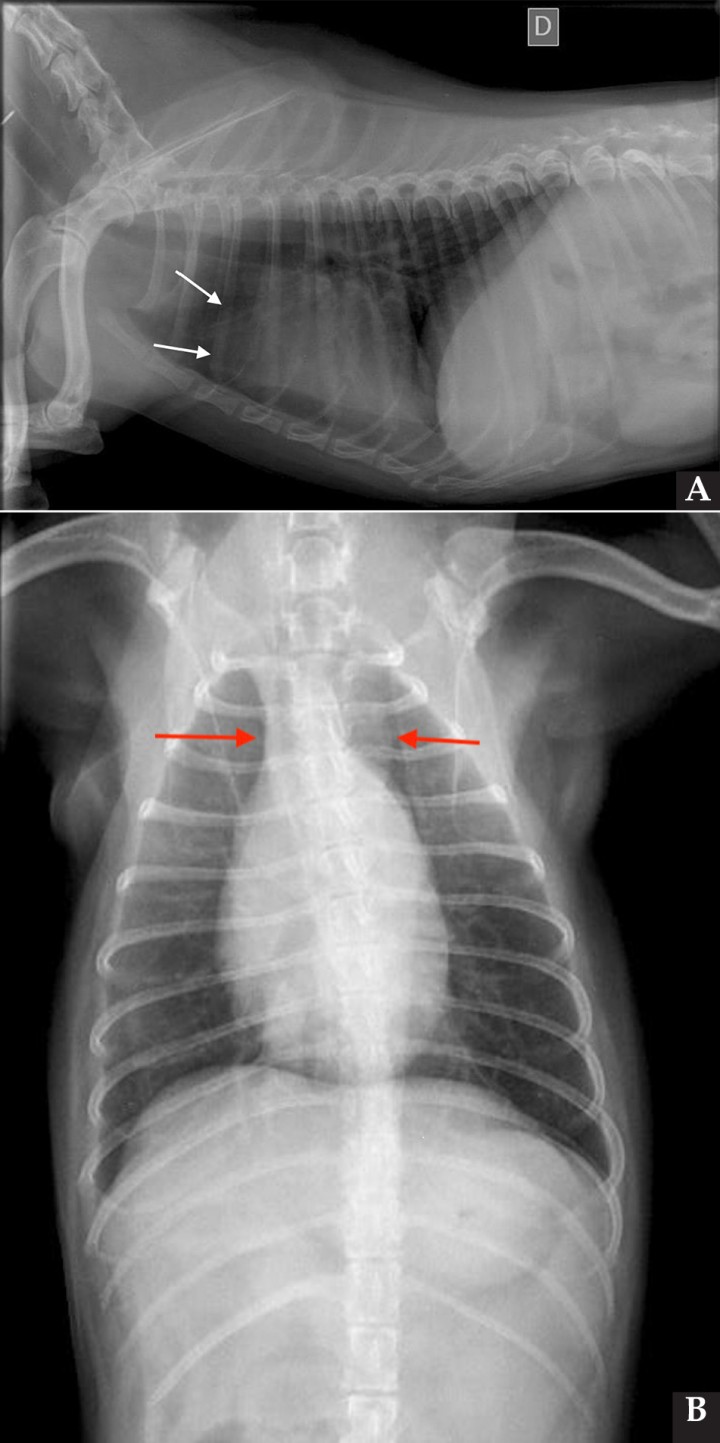
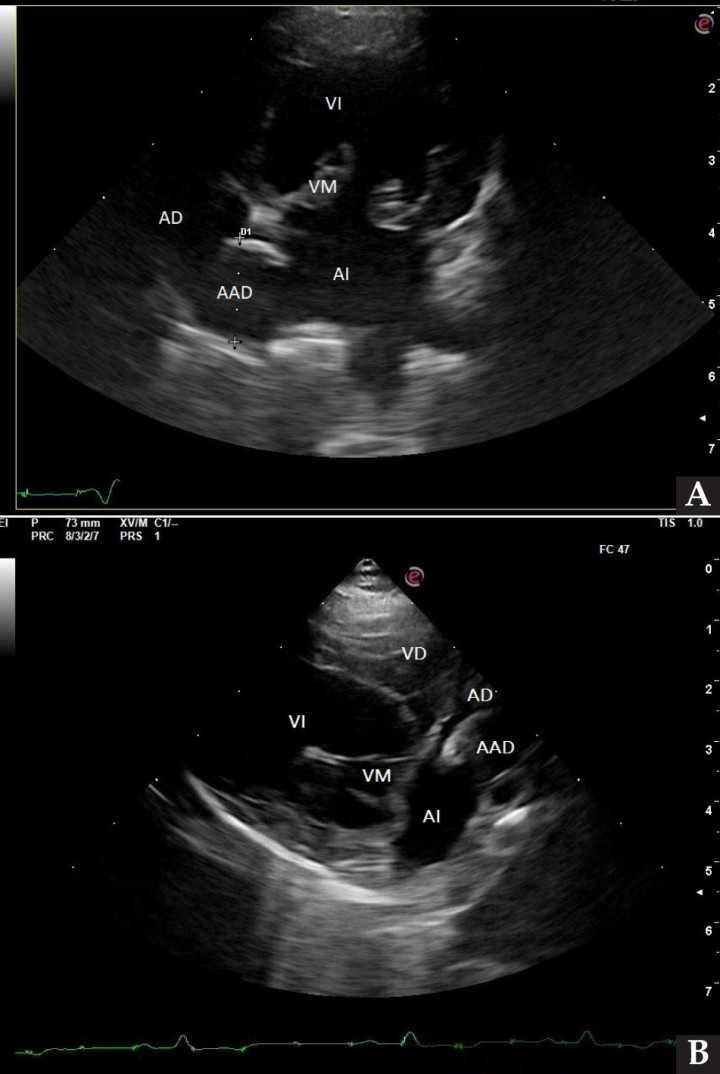
Se realizaron radiografías torácicas y en la proyección lateral derecha se observó, craneal a la silueta cardiaca, una opacidad tejido blando mal definida que producía efecto silueta positivo con esta. La tráquea se visualizó desplazada dorsalmente y el atrio izquierdo aumentado de tamaño. El parénquima pulmonar mostraba un aumento de opacidad en su área caudodorsal, compatible con un patrón pulmonar intersticial no estructurado difuso, el cual se consideró normal debido a que la radiografía fue tomada en fase espiratoria inicial y a la condición corporal del paciente. En la proyección ventrodorsal, el mediastino craneal se observó en el límite superior de tamaño, presentándose un tamaño dos veces superior a la anchura de la vértebra torácica (Fig. 1). Este cambio es compatible con una imagen artefactual secundaria a la leve rotación que presenta la radiografía y a la condición corporal del paciente. El diagnóstico radiológico más probable fue una masa mediastínica craneoventral y cardiomegalia izquierda. En la ecocardiografía transtorácica se confirmó el diagnóstico de enfermedad degenerativa de la válvula mitral (EDVM), presentando engrosamiento, prolapso e insuficiencia valvular, dilatación del atrio izquierdo (AI/AO=1,9) y leve aumento de las dimensiones diastólicas del ventrículo izquierdo normalizado al peso del paciente (NLVDD=1,7). Las presiones de llenado intracardiacas se estimaron como normales, ya que el flujo transmitral presentó un patrón de relajación anómala y la velocidad pico de E fue de 0,8 m/s. En función de estos hallazgos se confirmó el diagnóstico de enfermedad degenerativa valvular mitral con cardiomegalia izquierda y sin hallazgos compatibles con insuficiencia cardiaca congestiva, por lo tanto en estadio ACVIM B2. En las vistas ecocardiográficas paraesternal derecha de 4 cámaras y apical izquierda de 4 cámaras se visualizó una estructura redondeada y anecógena de 15 mm, con flujo sanguíneo en Doppler color, adyacente al corazón (Fig. 2). Este hallazgo es compatible con dilatación aneurismática de las estructuras vasculares o las cavidades cardiacas, si bien no se pudo establecer continuidad con ninguna de ellas en la ecografía. La valoración con Doppler pulsado de los tractos de salida del ventrículo izquierdo y derecho mostró la repetición de un perfil de flujo con disminución del área bajo la curva en el segundo latido con respecto al precedente.
Figura 1
Radiografías torácicas en proyección lateral derecha (A) y ventrodorsal (B) donde se visualiza el área de opacidad de tejido blando craneal a la silueta cardíaca (flechas blancas). En la proyección ventrodorsal se visualiza el mediastino craneal que se presenta en el límite superior de grosor (flechas rojas).
Figura 2
Ecocardiografía. (A) Vista apical izquierda de 4 cámaras optimizada para ADD. Engrosamiento de la válvula mitral (VM), dilatación moderada de atrio izquierdo (AI) y ventrículo izquierdo (VI). Estructura redondeada y anecógena de 15 mm con flujo sanguíneo (AAD), adyacente al corazón. AD: atrio derecho. (B) Vista paraesternal derecha de 4 cámaras optimizada para el atrio izquierdo. Estructura redondeada y anecógena (AAD) asociada al corazón. AD: atrio derecho.
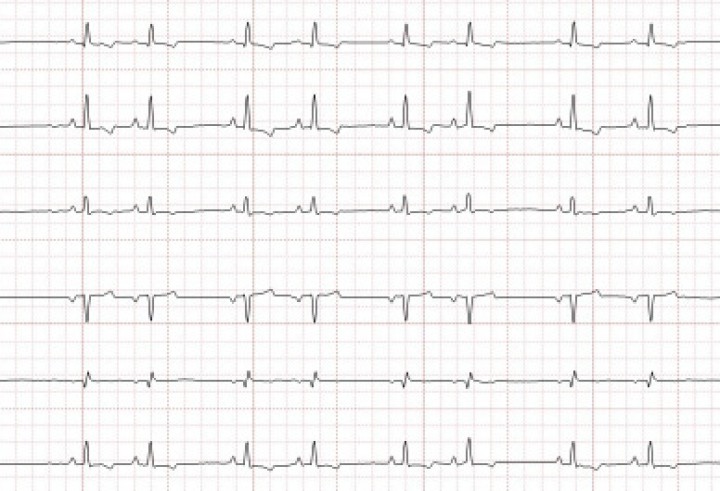
En el registro electrocardiográfico se observó un ritmo irregular en el que alternaron latidos sinusales y prematuros. La morfología del QRS de los latidos prematuros fue de complejos estrechos (<70 ms) y muy similares al latido sinusal precedente. La cadencia del ritmo era de dos complejos estrechos con intervalo RR estable. Este patrón de QRS estrecho-QRS estrecho-pausa se repitió de manera continuada y fue independiente de las fases del ciclo respiratorio. El primer QRS venía precedido de una onda P sinusal y el complejo prematuro de una P’ con diferente morfología, lo que se interpretó como actividad atrial ectópica. La realización de un ECG de 6 derivaciones permitió analizar la morfología de la onda P’, que fue positiva en derivaciones I, II, III y aVF, y negativa en derivaciones aVR y aVL (Fig. 3). El diagnóstico electrocardiográfico fue de complejos prematuros atriales frecuentes (ritmo bigémino atrial).
Figura 3
Electrocardiograma de 6 derivadas. Complejos prematuros atriales frecuentes (bigémino). Onda P’ positiva en derivaciones I, II, III y aVF, y negativa en derivaciones aVR y aVL.
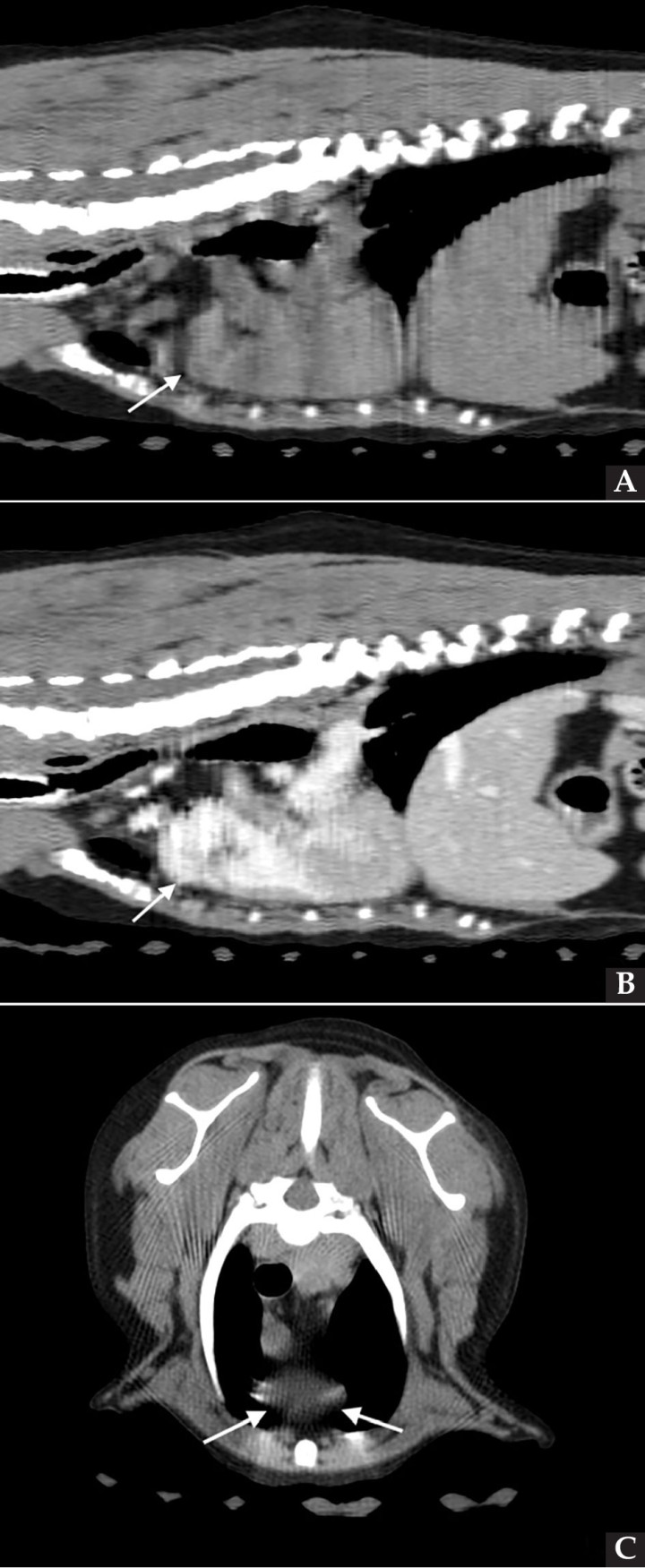
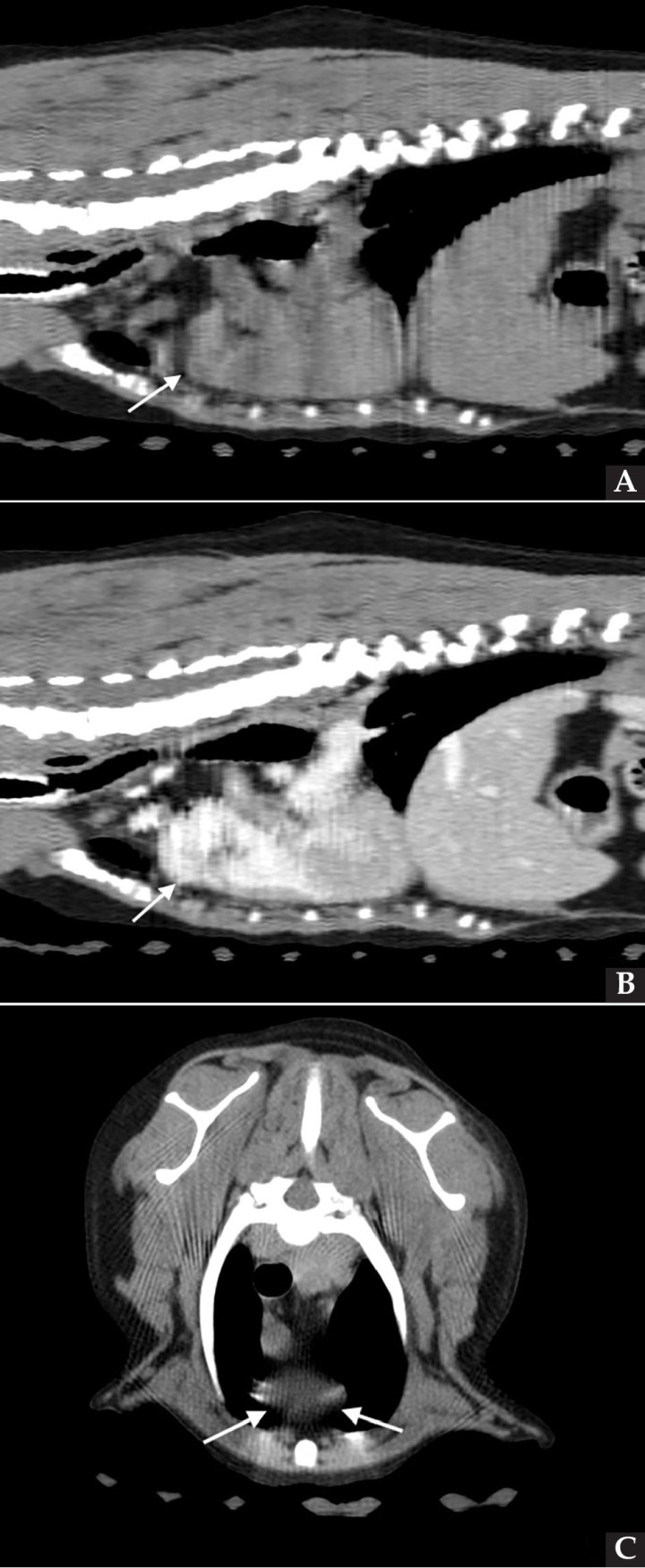
Se realizó una angio-TC de la cavidad torácica para caracterizar la masa mediastínica craneoventral. El estudio se realizó bajo anestesia general y con la paciente en decúbito esternal. Se realizaron series pre-contraste y post-contraste, inmediatamente y a los 3 minutos tras la administración de un contraste iodado hidrosoluble no iónico (iopromida 300 mg I/ml a una dosis de 600 mg I/kg intravenoso, administrado de forma manual) con cortes de 3 mm de grosor e intervalo 1,5 mm con algoritmo estándar (tejido blando) y pulmón. El estudio de TC se evaluó en ventana de tejido blando, hueso y pulmón, visualizándose en el área craneal al atrio derecho una estructura redondeada y bien definida (22UH) de medidas aproximadas 1,95 cm DV x 1,87 CrCd x 2,5 cm LL (Figs. 4 y 5). Tras la administración de contraste, esta estructura se llenó rápidamente de contraste de forma homogénea, observándose una comunicación con el atrio derecho, midiendo el área de la comunicación 1,43 cm. El diagnóstico presuntivo fue de un aneurisma de la aurícula derecha.
Figura 4
Imágenes de Tomografía Computarizada. Reconstruidas en plano sagital, simples (A) e inmediatamente tras la administración del contraste (B), en plano transversal, simples (C).
Figura 5
Imágenes de Tomografía Computarizada. Inmediatamente tras la administración de contraste (A) en ventana de tejido blando. Se observa una estructura quística en la zona craneal del atrio derecho y que contacta con la aurícula derecha, rellenándose de contraste inmediatamente tras su administración (flechas blancas). (B) Imagen reconstruida en volumen rendering, donde se visualiza el aumento de tamaño de la aurícula derecha (flecha blanca).
Se instauró tratamiento con pimobendán (Vetmedin 1,25 mg, Boehringer Ingelheim, Ingelheim, Alemania) a 0,3 mg/kg/12 h y clopidogrel (Plavix 75 mg, Sanofi-Aventis groupe, París, Francia) a 2 mg/kg cada 24 horas, sin cambios en los signos clínicos a los 7 días. En el seguimiento realizado a los seis meses el propietario describió una actitud normal y ausencia de intolerancia al ejercicio, tras diagnóstico y tratamiento de osteoartrosis por el traumatólogo veterinario. No se detectaron cambios en los hallazgos del examen físico con respecto al primer día.
Discusión
Los aneurismas de aurícula derecha (AAD) son una patología cardiaca rara en el perro1-6 y también en medicina humana.7-10 Se ha descrito también un caso en un gato11 y una serie de casos en bovinos.12 El aneurisma se define como una dilatación vascular y, en veterinaria, la definición propuesta para el aneurisma de aurícula derecha es de dilatación de la aurícula derecha en ausencia de dilatación del atrio derecho y con clara comunicación entre la aurícula dilatada y el atrio derecho.6 En los casos publicados en veterinaria, la etiología se ha descrito como congénita1,3 o adquirida.2 Pueden estar causados por la herniación de la aurícula derecha a través de un defecto del saco pericárdico,2,4 aunque también se han descrito casos sin defecto del pericardio.3 En los casos, como el nuestro, en los que no se ha realizado la cirugía o un estudio post mortem, no es posible asegurar si está presente o no este defecto.1,5,6
En cuanto a las características de los animales en la especie canina, no se ha demostrado ninguna predisposición en cuanto a la raza, el sexo y la edad, si bien la mayoría de los casos publicados son perros de razas pequeñas o medianas y animales de edad avanzada1-6 como en nuestro caso. En humana, las etiologías son similares, el rango de edad al diagnóstico muy amplio y se sugiere una ligera predisposición en mujeres.7
La sintomatología y los hallazgos del examen físico observados en nuestra paciente fueron poco específicos. Las alteraciones en el ritmo y el pulso se consideraron consecuencia de la arritmia. En la mayoría de los casos publicados en medicina veterinaria, los animales no presentaban síntomas directamente atribuibles a la presencia del aneurisma6 y en nuestro caso no se consideró que la sintomatología tuviera relación con el aneurisma ni con la arritmia, ya que la intolerancia al ejercicio se resolvió sin que cambiaran los hallazgos del examen físico ni del electrocardiograma. Los signos clínicos más frecuentemente descritos en perros se asocian a arritmias supraventriculares con elevada frecuencia ventricular o a patologías concurrentes.1-6 En humanos un tercio de los casos de AAD son asintomáticos y los síntomas más descritos son palpitaciones, dolor de pecho y dificultad respiratoria, así como presencia de arritmias supraventriculares.8 La fibrilación atrial es la arritmia que con mayor frecuencia se ha asociado al aneurisma de aurícula derecha en veterinaria.2,4,5 En nuestro caso, como en los descritos en la bibliografía,1-6 la alteración del ritmo es de origen supraventricular y el análisis de la morfología de la onda P´ hace probable que el origen de los complejos prematuros sea el techo del atrio derecho.13 El diagnóstico electrocardiográfico fue de complejos prematuros atriales frecuentes (bigémino), que explica la alternancia en el pulso femoral y los cambios en la velocidad de los flujos de los tractos de salida en el Doppler pulsado. Este ritmo también podría ser compatible con un bloqueo sinoatrial/parada sinusal, algo que en razas braquicéfalas como el Chihuahua puede ser considerado fisiológico debido al aumento de tono parasimpático que presentan. La realización de un Holter 24 horas podría haber proporcionado más información sobre la arritmia, valorar su posible repercusión hemodinámica y orientar un posible tratamiento, pero no se realizó en este caso por decisión del propietario.
En humanos, la relación entre los aneurismas y las taquiarritmias supraventriculares no se ha explicado completamente. Se ha propuesto la hipótesis de que el propio tejido atrial podría ser responsable, ya sea proporcionando superficies extensas sobre las que podrían ocurrir movimientos circulares o conteniendo focos ectópicos excitables.14 En uno de los casos publicados en veterinaria la irritación del epicardio por la constricción del defecto pericárdico alrededor de la aurícula derecha se consideró un factor desencadenante de la fibrilación atrial.2 En nuestro caso, no se confirmó la presencia o no de defecto pericárdico.
En cuanto a enfermedades cardiacas concurrentes, en los casos descritos previamente cuatro perros presentaban EDVM,1-3,6 dos de ellos cardiomegalia derecha,2,5 uno estenosis subaórtica y estenosis pulmonar leve6 y en otro se identificó un trombo en atrio derecho.6 La presencia concomitante de EDVM en este caso se debe a la alta prevalencia de esta patología en caninos de edad avanzada y raza pequeña o mediana.15 En nuestro caso, la EDVM no contribuyó a la presencia de signos clínicos, ya que se encontraba en fase asintomática, concretamente en estadio ACVIM B2.15
El diagnóstico del AAD en caninos es muy complejo con las técnicas convencionales de imagen. En las radiografías torácicas observamos una opacidad tejido blando en mediastino craneoventral, que es el hallazgo radiológico más frecuentemente descrito en los casos publicados,1-6 aunque no siempre se han identificado anomalías radiográficas.6 En medicina humana, el diagnóstico del AAD se confirma mediante ecocardiografía transtorácica en la mayoría de los casos.7-10,16 La ecocardiografía transesofágica se considera superior para el diagnóstico de los aneurismas de aurícula izquierda7 y es una modalidad cuya utilidad no se ha investigado en medicina veterinaria. En nuestra paciente la ecocardiografía mostró una estructura anecógena adyacente al atrio derecho, pero no fue posible realizar un diagnóstico concluyente. Esto se debe a que en la especie canina la posición anatómica del pulmón dificulta la visualización del aneurisma en el examen ecocardiográfico, por lo que no se puede descartar el diagnóstico por los resultados de la ecocardiografía.1-5 De los casos anteriormente publicados, en dos de ellos se identificó una estructura conteniendo fluido anecógeno1,6 y en otro una gran estructura anecoica craneal al atrio derecho;3 el resto no mostraron ningún hallazgo ecocardiográfico atribuible al aneurisma.2,4,5
El diagnóstico definitivo del AAD en caninos ha requerido en todos los casos de angiografía no selectiva1,2 o angio-TC,2-6 como en nuestro caso. La angio-TC va a aportar un mejor abordaje de la anatomía, relación de estructuras adyacentes, anomalías congénitas asociadas, así como la presencia de otras alteraciones. Los hallazgos más frecuentemente descritos fueron dilataciones bulbares y fusiformes, y la media de dimensiones para los aneurismas de aurícula derecha fue de 2,9 x 2,5 x 2,4 cm (longitud x anchura x altura) y la media de tamaño del istmo fue de 1,2 cm6, similares a los valores obtenidos en nuestra paciente. Se instauró un tratamiento en este caso con pimobendán para prolongar la fase asintomática de la enfermedad mitral.15,17 El clopidogrel se utilizó como tratamiento empírico para la prevención de tromboembolismo. Aunque las enfermedades cardiacas caninas no se consideran una condición predisponente a la formación de trombos,18 se decidió usar el tratamiento antiagregante plaquetario por la probable presencia de estasis sanguíneo en la cámara dilatada, la asociación de aneurismas de aurículas y tromboembolismo en humanos8 y la descripción de trombos2,6 o riesgo16 en algunos de los casos publicados en veterinaria. En medicina humana, se recomienda la resección quirúrgica7 o toracoscópica19 del aneurisma en pacientes sintomáticos y para prevenir las arritmias y eventos tromboembólicos. La cirugía se ha realizado en un perro con aneurisma de aurícula izquierda con éxito.18 Sin embargo, la mayoría de casos publicados en veterinaria no han recibido tratamiento o solo tratamiento antiarrítmico o de comorbilidad,1-6 como en el caso aquí descrito. El AAD se considera una condición de pronóstico favorable si se observa de forma incidental o con síntomas leves.6
En conclusión, el AAD es una patología infrecuente y con signos clínicos inespecíficos que debe tenerse en cuenta en el diagnóstico diferencial de los pacientes que presenten hallazgos radiográficos compatibles con posible masa en mediastino craneoventral, siendo la angio-TC la mejor opción para alcanzar el diagnóstico.
Fuente de financiación: este trabajo no se ha realizado con fondos comerciales, públicos o del sector privado.
Conflicto de intereses: los autores declaran que no existe conflicto de intereses.
Bibliografía
- 1.
Murphy LA, Russell NJ, Nakamura RK. Right atrial aneurysm in a dog. J Small Anim Pract 2019; 60(1): 62.
[PubMed] - 2.
Schwarz T, Willis R, Summerfield NJ, Doust R. Aneurysmal dilatation of the right auricle in two dogs. J Am Vet Med Assoc 2005; 226(9): 1512-1515.
[PubMed] - 3.
Baron Toaldo M, Diana A, Morini M, Cipone M. Imaging diagnosis intrapericardial right auricle aneurysm in a dog. Vet Radiol Ultrasound 2010; 51(5): 512-515.
[PubMed] - 4.
Nakamura T, Tateishi H, Ishikawa C, et al. A Dog with Right Auricular Aneurysm Diagnosed with Computed Tomography Angiography. 動物の循環器 2014; 47(2): 41-46.
- 5.
Hogan KM, Tai JC. What Is Your Diagnosis? J Am Vet Med Assoc 2020; 257(1): 33-36.
[PubMed] - 6.
Masson AV, Maddox TW, Bode EF, Mortier JR. Clinical and diagnostic imaging findings in dogs with atrial appendage aneurysm: 7 cases (2014-2020). J Vet Cardiol 2021; 35: 63-73.
[PubMed] - 7.
Aryal MR, Hakim FA, Giri S et al. Right atrial appendage aneurysm: a systematic review. Echocardiography 2014; 31(4): 534-539.
[PubMed] - 8.
Chockalingam A, Alagesan R, Gnanavelu G, Dorairajan S, Subramaniam T. Right atrial aneurysm in adults: report of three cases and review of literature. Echocardiography 2004; 21(7): 639-643.
[PubMed] - 9.
Chatrath R, Turek O, Quivers ES, et al. Asymptomatic giant right atrial aneurysm. Tex Heart Inst J 2001; 28(4): 301-303.
[PubMed] - 10.
Yildirim N, Gölbasi Z. Echocardiographic diagnosis of a case with giant right atrial aneurysm. Echocardiography 2006; 23:140-142.
[PubMed] - 11.
Boujon C, Amberger C, Lombard C. Right ventricular aneurysm and atrial septal defect in a cat. J Vet Cardiol 2004; 6(2): 44-48.
[PubMed] - 12.
Biasato I, Biasibetti E, Gili S, et al. Right atrial appendage aneurysms in veal calves and beef cattle: anatomopathological investigations and aetiopathogenetic hypotheses. J Vet Cardiol 2017; 19(1): 68-73.
[PubMed] - 13.
Santilli R. Supraventricular beats and rhythms. In Electrocardiography of the dog and cat, 2nd Edition, Milano, Edra, 2018; 87-88
- 14.
Zeebregts CJ, Hensens AG, Lacquet LK. Asymptomatic right atrial aneurysm: fortuitous finding and resection. Eur J Cardiothorac Surg 1997; 11(3): 591-593.
[PubMed] - 15.
Keene BW, Atkins CE, Bonagura JD, et al. ACVIM consensus guidelines for the diagnosis and treatment of myxomatous mitral valve disease in dogs. J Vet Intern Med 2019; 33(3): 1127-1140.
[PubMed] - 16.
Rosselli D, Schmiedt C, Kirejczyk S, et al. Surgical resection of a left auricular aneurysm in a dog. J Vet Cardiol 2019; 23: 15-20.
[PubMed] - 17.
Boswood A, Häggström J, Gordon SG et al. Effect of Pimobendan in Dogs with Preclinical Myxomatous Mitral Valve Disease and Cardiomegaly: The EPIC Study-A Randomized Clinical Trial. J Vet Intern Med 2016; 30(6): 1765-1779.
[PubMed] - 18.
De Laforcade A, Bacek L, Blais MC, et al. Consensus on the Rational Use of Antithrombotics in Veterinary Critical Care (CURATIVE): Domain 1-Defining populations at risk. J Vet Emerg Crit Care (San Antonio) 2019; 29(1): 37-48.
[PubMed] - 19.
Hiraoka A, Tachibana H, Yoshitaka H, Sakaguchi T. Giant aneurysm of the right atrial appendage repaired by minimally invasive approach. J Card Surg 2019; 34(11): 1352-1353.
[PubMed]