Caso clínico de... Anestesia
G. Polo-Paredes, S. Carrillo-Flores, M. S. Echalecu, H. G. Bernal, F. G. Laredo, E. Belda
Contacto: gonzalopolopar@gmail.com
Historia
Se presentó en el Hospital Veterinario una perra esterilizada, mestiza de Rottweiler de 10 años de edad y 38 kg (Fig. 1), por la presencia de una masa de aspecto esférico de 1x1 cm en el aspecto lateral de la rodilla derecha. Como antecedentes clínicos, presentaba infección por Leishmania actualmente inactiva y sin tratamiento, cirugía correctora (TPLO) de rotura de ligamento cruzado craneal en la extremidad posterior derecha (EPD), realizada 294 días antes de la presentación actual, e incontinencia urinaria tratada con estriol.
Figura 1
Paciente sometida a la exéresis.
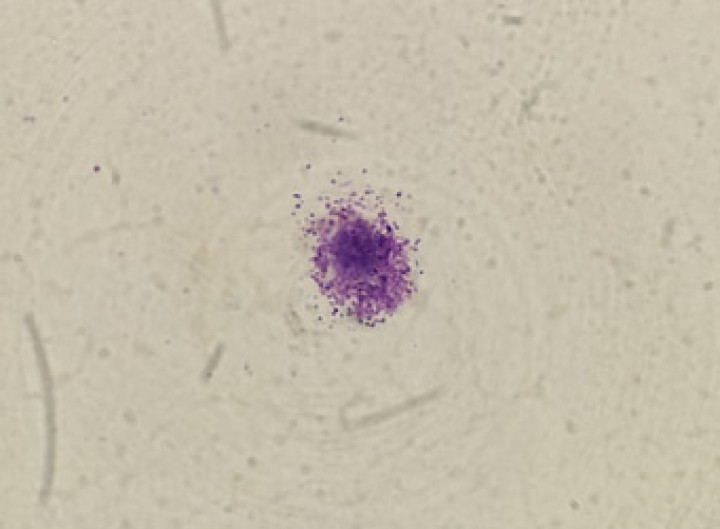
Se realizó una citología de la masa en la que se observaron mastocitos de aparente bajo grado de malignidad según la escala de Kiupel1 (Fig. 2). Tras la evaluación preanestésica, en la que se incluyeron hemograma y bioquímica sanguínea, radiografías del tórax, ecografía abdominal y ecocardiografía, no se observaron alteraciones sistémicas relevantes, salvo una ligera leucopenia y neutropenia [leucocitos: 4,34 x 103/μl (ref.: 5,20-14,00 x 103/μl); neutrófilos: 2,35 x 103/μl (ref.: 3,10-11,00 x 103/μl)]. La paciente se clasificó como ASA II.
Figura 2
Mastocito en citología de la masa. Obtenido con tinción hematoxilina-eosina en microscopio óptico con lente de objetivo de inmersión en aceite (100x).
¿Cuál es la principal particularidad de este tipo de tumores y qué consecuencias podría tener?
Los mastocitomas son el principal tumor cutáneo en pacientes caninos atendidos en hospitales veterinarios.2 Su prevalencia es significativamente superior en perros de raza bóxer y boston terrier, abarcando más del 50 % del total, sin predilección de género. Un 50-60 % de estas masas se localizan en el tronco, un 25-40 % en las extremidades y un 10 % en el cuello. Estas neoplasias surgen de los mastocitos y su origen se presupone multifactorial; la presencia de protooncogenes c-kit y su mutación favorecen la proliferación de estas células.
Los mastocitos almacenan vesículas en su citoplasma que contienen factores proinflamatorios. Ante un estímulo químico o físico, estas células liberan (degranulan) esas vesículas al medio y al torrente sanguíneo. Uno de los factores proinflamatorios más importantes es la histamina, cuya liberación puede provocar un choque anafilactoide caracterizado por vasodilatación arterial y venosa, con aumento de la permeabilidad vascular, edemas, hipotensión y taquicardia compensatoria. A nivel respiratorio la broncoconstricción puede comprometer la capacidad ventilatoria del paciente. Todo ello puede desencadenar una insuficiencia cardiorrespiratoria aguda y la muerte del paciente.
¿Se podría paliar farmacológicamente el efecto de la liberación de histamina de manera previa a la cirugía?
La histamina se une sobre células diana, a receptores clasificados en cuatro subtipos (H1, H2, H3 y H4). Los efectos cardiovasculares están causados por la activación de receptores H1 y H2. Sanchez et al.3 demostraron que la administración, de manera individual, de difenhidramina (un agonista inverso del receptor H1, que estabiliza la forma inactiva del receptor, impidiendo la acción de la histamina) no era capaz de prevenir los efectos cardiovasculares de la histamina. Así pues, diversos autores3-5 recomiendan la administración conjunta de bloqueantes H1 y H2 antes de la cirugía para prevenir de modo más efectivo las consecuencias de una posible liberación de histamina, lo que en esta paciente nos llevó a combinar difenhidramina (2 mg/kg TID PO) como bloqueante H1 (Soñodor®, Difenhidramina 50 mg comprimidos, Laboratorios Urgo S.L, Guipúzcoa, España), y famotidina (0,5 mg/kg BID PO) como bloqueante H2 (Famotidina 20 mg comprimidos, Laboratorios Normon S.A, Tres Cantos, España), tres días antes de la cirugía.
¿Cuáles serían las posibles consecuencias de la administración de opioides en pacientes con mastocitoma?
El uso de opioides es capaz de provocar la liberación de histamina,5 aunque esta no depende de la activación de receptores opioides específicos. Así, el empleo de agonistas parciales como la buprenorfina o antagonistas del receptor mu como la naloxona o el butorfanol no reducen el riesgo. Los diferentes tipos de opioides no son equipotentes, un dato relevante, ya que la cantidad de histamina liberada está directamente relacionada con la concentración plasmática de opioide. Así se explica por qué la petidina produce más liberación de histamina que la morfina, y esta última más que el fentanilo (más potente, por lo que se administra a dosis más baja). Pese a todo, esta teoría no explicaría por qué la metadona, un opioide que administrado a las dosis habituales alcanza una concentración plasmática parecida a la morfina, produce menor liberación de histamina. Se necesitan más estudios para esclarecer el origen de la degranulación asociada a opioides. El fentanilo, al producir menor degranulación, sería el opioide más estable desde un punto de vista cardiovascular.
La relación entre la cantidad de histamina liberada y la magnitud de sus efectos cardiovasculares también es impredecible. Por ello, la manipulación de una masa pequeña (1 x 1 cm), como en nuestro caso, podría causar efectos cardiovasculares similares o incluso mayores que una masa más grande, pese a liberar menos histamina. Ante los riesgos descritos, se plantea la pregunta que abordamos a continuación.
¿Sería posible realizar un manejo anestésico que evitase o redujese el uso de opioides (Opioid-Free/Sparing Anaesthesia)?
Para la exéresis del mastocitoma descrito, se optó por un tratamiento analgésico multimodal, sin la utilización de opioides, empleando para ello cuatro tipos de fármacos distintos: la dexmedetomidina (agonista alfa-2 adrenérgico), la ketamina (antagonista de receptores NMDA), el meloxicam (antiinflamatorio no esteroideo, AINE) y la bupivacaína (anestésico local, bloqueante de canales de sodio).
Tras colocar un catéter de 18 G en la vena cefálica derecha, se premedicó con dexmedetomidina (Dexdomitor 0,5 mg/ml, OrionPharma, Espoo, Finlandia; 2 μg/kg IV), lo que indujo un estado de sedación moderado. A continuación, se preoxigenó con O2 al 100 % durante 5 minutos con una mascarilla usando un circuito tipo Bain (200 ml/kg/min). La anestesia se indujo con una combinación de ketamina (Anesketin 100 mg/ml, Dechra, Bladel, Países Bajos; 2 mg/kg IV) y propofol IV a efecto (PropoVet Multidosis 10 mg/ml, Zoetis, Madrid, España; dosis final 0,5 mg/kg). Posteriormente, se intubó la tráquea con un tubo orotraqueal de 12 mm de diámetro interno y se mantuvo la anestesia con isofluorano 1,5 % usando un circuito circular coaxial “F-universal”. Se instauró una infusión IV de ketamina a un ritmo constante (0,6 mg/kg/h), que se mantuvo hasta el final de la anestesia (100 minutos). Una vez estabilizado el plano anestésico, se colocó un catéter de 20 G en la arteria pedal dorsal de la extremidad posterior izquierda.
Tras rasurar y desinfectar la EPD, se realizó un bloqueo ecoguiado de los nervios ciático (Fig. 3A) y safeno (Fig. 3B) en el fémur medio,6 con bupivacaína 0,5 % (Bupivacaina 5 mg/ml, B Braun, Rubí (Barcelona), España; 0,1 ml/kg/nervio) y dexmedetomidina (1 μg/kg/nervio). Para ello se utilizó una sonda lineal multifrecuencia 3-13 MHz (MyLab Gamma, Esaote, Florencia, Italia) y agujas sonovisibles (Ultraplex® 360 x 10 mm, 30º, BBraun, Melsungen, Alemania).
Durante la anestesia se monitorizó temperatura esofágica, frecuencia cardiaca, electrocardiografía, presión arterial invasiva y no invasiva (oscilometría), frecuencia respiratoria, pulsioximetría, capnografía, espirometría y fracción inspirada y espirada de isoflurano. La paciente fue ventilada mecánicamente en modo controlado por volumen con un volumen tidal de 10 ml/kg, presión positiva al final de la espiración (PEEP) de 5 cm H2O, relación inspiración/espiración de 1:2,5 y FR de 14 rpm. Esta última se fue modificando para asegurar et CO2 entre 35 y 45 mmHg.
La exéresis del mastocitoma se efectuó mediante incisión circunferencial en la piel con 2 cm de margen a la lesión en sus 360º, y en el plano profundo mediante resección de parte de la fascia lata y fascia del bíceps femoral. Se realizó un cierre por planos con una sutura monofilamento sintético absorbible 2/0 (Monosyn®, B. Braun VetCare, S.A, Barcelona), con un patrón de sutura con puntos simples en X para la aproximación del plano profundo, y sutura continua en el tejido subcutáneo. En la piel, se realizó un patrón intradérmico con la misma sutura en calibre 3/0.
Durante el periodo intraoperatorio (duración total de 25 minutos), no se observaron alteraciones en los parámetros monitorizados respecto a su valor previo a la incisión, lo cual resultó compatible con la ausencia de estimulación nociceptiva y liberación de histamina.
Tras la recuperación se evaluó la analgesia siempre por el mismo observador a los 0, 30, 60, 90 minutos, y a las 2, 3, 4, 6, 8, 12, 24, 36, 48, 60 y 72 horas tras la extubación, mediante el modelo abreviado de la Escala de Glasgow para valoración del dolor agudo. Los valores obtenidos oscilaron entre 0-2/20-24. La capacidad de apoyo del miembro posterior y su propiocepción se recuperaron completamente 36 horas tras la extubación. En este periodo la paciente fue medicada con meloxicam (Canidolor 5 mg/ml, Fatro, Sant Just Desvern (Barcelona), España; 0,2 mg/kg SC) el primer día, reduciendo la dosis a 0,1 mg/kg los dos días posteriores.
El examen histopatológico posterior confirmó que se trataba de un mastocitoma cutáneo de grado II/bajo grado con márgenes limpios.
Discusión
Según la información de los autores, este caso supone la primera descripción del uso de una técnica anestésica libre de opioides para la exéresis de un mastocitoma en perro. La realización de una técnica alternativa de analgesia multimodal, incluyendo el uso de anestesia locorregional, resultó clave para controlar la nocicepción/dolor de modo efectivo, a la vez que evitamos el riesgo de liberación de histamina asociada a opioides en este escenario. Además, la administración de opioides puede contribuir a aumentar el riesgo de metástasis tumoral.7 Su omisión evitaría contribuir a la progresión y expansión tumoral.
El uso preventivo de bloqueantes de los receptores H1 y H2 se ha propuesto como un método eficaz en la prevención de los efectos de la histamina en caso de degranulación.4 En nuestro caso, se optó por la administración conjunta de difenhidramina (bloqueante H1) y famotidina (bloqueante H2), tres días antes de la cirugía para paliar los posibles efectos cardiovasculares de la histamina gracias al bloqueo de ambos receptores (H1 y H2). La ausencia de alteraciones hemodinámicas y ventilatorias intraoperatorias parecen indicar que la combinación de estos dos fármacos pudo resultar efectiva, siempre vista dentro del conjunto de las medidas adoptadas.
Nuestra paciente fue premedicada con dexmedetomidina con los objetivos de obtener un grado de sedación adecuado para su manejo y la primera aproximación a una analgesia perioperatoria efectiva, gracias a su acción sobre los receptores alfa-2 agonistas.8 Otra alternativa hubiera sido el empleo de acepromacina en lugar de dexmedetomidina, ya que también se describe la actividad antihistamínica de este tranquilizante; sin embargo, hubiésemos privado a la paciente del efecto analgésico8 del agonista alfa-2.
La coinducción anestésica fue realizada con una combinación de ketamina y propofol. La ketamina ha demostrado ser capaz de reducir los efectos cardiovasculares del propofol, caracterizados por una reducción en la resistencia vascular periférica y en el gasto cardiaco, resultando en hipotensión sistémica.9 Esta actividad de la ketamina se debe a que, en pacientes sanos (ASA I/II), produce una estimulación del sistema simpático que a nivel hemodinámico se caracteriza por un aumento del gasto cardiaco, la frecuencia cardiaca y la presión arterial. Sin embargo, resulta importante considerar que en pacientes críticos la ketamina puede inducir una depresión miocárdica directa, por lo que no resultaría un fármaco de elección. Durante la coinducción con ketamina se debe prestar especial atención a la ventilación del paciente, pudiendo ser asistida manualmente o mecánicamente como en este caso, ya que la depresión respiratoria es mayor que si se emplease solamente propofol. La ketamina puede causar, además, alteraciones del estado psicomotor, rigidez muscular y disforia, si no se combina con fármacos depresores del sistema nervioso central, tales como los agonistas alfa-2 adrenérgicos o las benzodiacepinas.8 En nuestro caso, durante la inducción anestésica, se observó un ligero aumento de la frecuencia cardiaca y la presión arterial, sin apnea ni efectos psicomotores. La administración de ketamina en infusión continua permitió aportar una analgesia somática durante todo el procedimiento y prevenir estados de hiperalgesia. Esta capacidad analgésica deriva de su acción antagonista sobre los receptores NMDA a nivel del asta dorsal de la médula espinal, reduciendo además la aparición de posibles cuadros de sensibilización central.8 Sin embargo, el uso de ketamina podría considerarse controvertido, ya que, pese a la ausencia de reporte de casos clínicos, ha sido relacionada con un aumento de metástasis pulmonar de adenocarcinoma mamario en ratas.7
El bloqueo ecoguiado de los nervios ciático y safeno es una técnica útil y relativamente sencilla que permite impedir la transmisión del potencial de acción de los nervios (bloqueo canales del Na+), afectando a la función sensitiva y motora a partir del tercio distal del fémur. El bloqueo del ciático a nivel del fémur medio va a aportar analgesia a nivel distal a la fosa poplítea con bloqueo motor del tarso. Por otro lado, el bloqueo del nervio safeno (rama sensitiva) que se independiza del nervio femoral a nivel inguinal facilita una excelente cobertura analgésica de la cara medial del miembro posterior hasta el dedo I, pero manteniendo la función motora del cuádriceps, lo cual mejora la funcionalidad de la extremidad y el confort de los pacientes. La elección de bupivacaína 0,5 % como anestésico local persigue el objetivo de prolongar la duración del bloqueo (hasta 6-8 horas) en comparación con otros anestésicos locales como la lidocaína o la mepivacaína (2 horas).8 Además, el uso como coadyuvante de la dexmedetomidina ha demostrado prolongar aún más el efecto de la bupivacaína.10 En nuestro caso, la paciente no recuperó completamente la función motora de la extremidad hasta 36 horas tras la extubación.
Durante el periodo intraoperatorio, los estímulos nociceptivos pueden provocar la estimulación del sistema simpático con un aumento de la frecuencia cardiaca, la presión arterial y/o la frecuencia respiratoria. Se considera que elevaciones de estos parámetros en un 20 % por encima de sus valores basales, previos a la cirugía, es compatible con presencia de nocicepción. En esta paciente, no se advirtieron cambios cardiorrespiratorios a lo largo de la cirugía, lo cual se interpretó como ausencia de nocicepción y liberación de histamina.
La analgesia en el periodo postoperatorio se valoró por medio de la escala de valoración del dolor de Glasgow. Nuestra paciente mostró valores de 0-2/20-24. En las primeras evaluaciones la paciente no era capaz de moverse, por lo que se valoró sobre un máximo de 20 puntos. A partir de los 90 minutos todas las evaluaciones fueron sobre un máximo de 24 puntos. Estos resultados fueron compatibles con una cobertura analgésica adecuada. Tras la recuperación anestésica y habiendo valorado la estabilidad hemodinámica de la paciente (PAM >70 mmHg), se optó por la administración de meloxicam para facilitar el control del dolor postoperatorio de tipo inflamatorio.8 Este fármaco de la familia de los AINE COX-2 preferenciales induce analgesia por inhibición de la síntesis de prostaglandinas E2 y leucotrienos en tejidos periféricos, cerebro y médula espinal. Posee efectos deletéreos, principalmente a nivel renal donde, ante fenómenos de hipotensión sistémica, la inhibición de la formación de prostaglandinas E2 puede alterar mecanismos de autorregulación, con una disminución de la perfusión renal y la tasa de filtración glomerular, conduciendo a daño renal agudo.
En conclusión, este caso muestra la viabilidad de un protocolo anestésico y una correcta cobertura analgésica postoperatoria basados en técnicas de analgesia multimodal libre de opioides para reducir el riesgo de la liberación de histamina durante la resección de mastocitomas.
Fuente de financiación: este trabajo no se ha realizado con fondos comerciales, públicos o del sector privado.
Conflicto de interés: los autores declaran que no existe conflicto de intereses.
Bibliografía
- 1.
Kiupel M, Webster J.D, Bailey K.L, et al: Proposal of a 2-Tier Histologic Grading System for Canine Cutaneous Mast Cell Tumors to More Accurately Predict Biological Behavior. Veterinary Pathology 2011; 48: 147-155.
[PubMed] - 2.
London C.A, Seguin B: Mast cell tumors in the dog. Vet Clin North Am Small Anim Pract 2003;33(3): 473-89.
[PubMed] - 3.
Sanchez A, Valverde A, Sinclair M, et al: Antihistaminic and cardiorespiratory effects of diphenhydramine hydrochloride in anesthetized dogs undergoing excision of mast cell tumors. J Am Vet Med Assoc 2017; 251(7): 804-813.
[PubMed] - 4.
Lorenz W, Doenicke A: H1 and H2 Blockade: A prophylactic principle in anesthesia and surgery against Histamine-release responses of any degree of Severity: Part 2. N Engl Reg Allergy Proc 1985;6(2): 174-194.
[PubMed] - 5.
Baldo BA, Pham NH: Histamine-releasing and allergenic properties of opioid analgesic drugs: Resolving the two. Anaesth Intensive Care 2012; 40(2): 216-235.
[PubMed] - 6.
Portela DA, Verdier N, Otero PE: Regional anesthetic techniques for the pelvic limb and abdominal wall in small animals: A review of the literature and technique description. Vet J 2018; 238: 27-40.
[PubMed] - 7.
Anderson S.L, Duke-Novakovski T, Singh N: The immune response to anesthesia: Part 2 sedatives, opioids and injectable anesthetic agents. Vet Anaesth Analg 2014; 41(6): 553-566.
[PubMed] - 8.
Duke-Novakovski T, de Vries M, Seymour C: BSAVA Manual of canine and feline anaesthesia and analgesia 3rd edition, Gloucester, British Small Animal Veterinary Association (ed), 2016.
- 9.
Kennedy MJ, Smith LJ: A comparison of cardiopulmonary function, recovery quality and total dosages required for induction and total intravenous anesthesia with propofol versus a propofol-ketamine combination in healthy Beagle dogs. Vet Anaesth Analg 2015; 42(4): 350-359.
[PubMed] - 10.
Di Bella C, Pennasilico L, Botto R et al: Efficacy of dexmedetomidine as adjuvant to bupivacaine in femoral-sciatic nerve blocks in dogs undergoing tibial plateau levelling osteotomy (TPLO). Res Vet Sci 2023; 154: 124-131.
[PubMed]