Linfoma mediastínico primario CD4+CD8+ en un perro
Primary mediastinal CD4+CD8+ lymphoma in a dog
M. Andueza-Medina, R. Garcia-Hernández, D. Chil-Jiménez, A. Artiles-Vizcaino, C. Rizkallal-Santana
Contacto: miguel.andueza@ivcevidensia.es
Resumen
Un perro de raza mestiza de American bully, hembra esterilizada de 2 años de edad, fue valorada por un cuadro clínico de apatía, temblores, poliuria/polidipsia e hiporexia asociados a azotemia e hipercalcemia. Después del examen físico, tomografía computarizada (TC), citometría de flujo (FC) y el análisis de reordenamientos de genes del receptor de antígeno por medio de pruebas basadas en reacción en cadena de la polimerasa (PARR) fue diagnosticada un linfoma tímico de células T doble positivo CD4/CD8, con características fenotípicas similares al timoma. Este caso muestra como la citometría de flujo (FC) combinada con otras modalidades como el estudio de la clonalidad (PARR) es útil para el diagnóstico preciso de masas mediastínicas.
Palabras clave: masa mediastínica, linfoma mediastínico, timoma, citometría de flujo, PARR.
Clin Vet Peq Anim 2023, 43 (4): 239-245
Summary
A two-year-old female spayed American Bully-mixed breed dog was evaluated for clinical symptoms of lethargy, tremors, polyuria/polydipsia, and hyporexia associated with azotemia and hypercalcemia. After physical examination, computed tomography (CT), flow cytometry, and polymerase chain reaction for antigen receptor rearrangement (PARR), a CD4/CD8 double-positive thymic T-cell lymphoma with phenotypic features similar to thymoma was diagnosed. This case shows that flow cytometry in combination with other diagnostic techniques such as clonality essay (PARR) are useful for the accurate diagnosis of mediastinal masses.
Keywords: mediastinal mass, mediastinal lymphoma, thymoma, flow cytometry, PARR.
Clin Vet Peq Anim 2023, 43 (4): 239-245

La presencia de este logo en un artículo de la revista indica que se publicará un examen sobre el mismo en la plataforma AVEPA Elearning. Su resolución aporta 0,15 créditos dentro del sistema de acreditaciones de especialidades veterinarias de AVEPA.
Introducción
El linfoma es una de las neoplasias más comunes diagnosticadas en perros y se estima que representa del 7 % al 24 % de todos los tumores caninos, y el 83 % de todas las neoplasias malignas hematopoyéticas caninas.1 La afectación del mediastino ocurre en el 22 % al 35,9 % de los perros con linfoma, porcentajes que aumentan hasta el 54 % para los perros con el fenotipo de células T.1-5 El linfoma mediastínico primario representa aproximadamente el 5 % de los diferentes tipos de linfoma diagnosticados en el perro, aunque esta población de pacientes no ha sido bien descrita en la literatura veterinaria. El fenotipo es casi exclusivamente de células T en la mayoría de los casos asociado a citomorfología linfoblástica, hipercalcemia y efusión pleural. El pronóstico de esta enfermedad es desfavorable, pero la supervivencia mejora cuando los pacientes son tratados con un protocolo de quimioterapia de agentes múltiples.1,6
Distinguir las dos causas más comunes de neoplasias mediastínicas, el linfoma y el timoma, mediante citología puede ser complicado.7,8 Es posible que la citología no sea concluyente porque ambos tipos de tumores estén compuestos por linfocitos pequeños de apariencia benigna, y obtener un diagnóstico histopatológico definitivo de una masa mediastínica puede ser un procedimiento invasivo.9
La citometría de flujo (FC) se ha convertido en la técnica de rutina en la evaluación de las neoplasias hematopoyéticas para la determinación de forma rápida y fiable de antígenos de superficie y citoplasmáticos en células obtenidas de nódulos linfáticos y otras masas con sospecha de neoplasias hematopoyéticas.9-11
Caso clínico
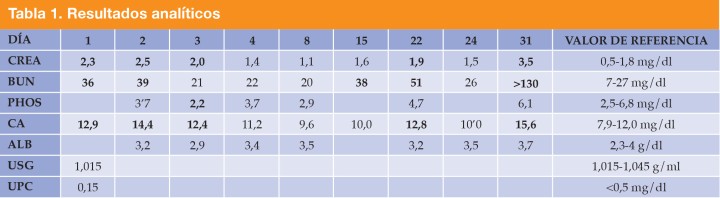
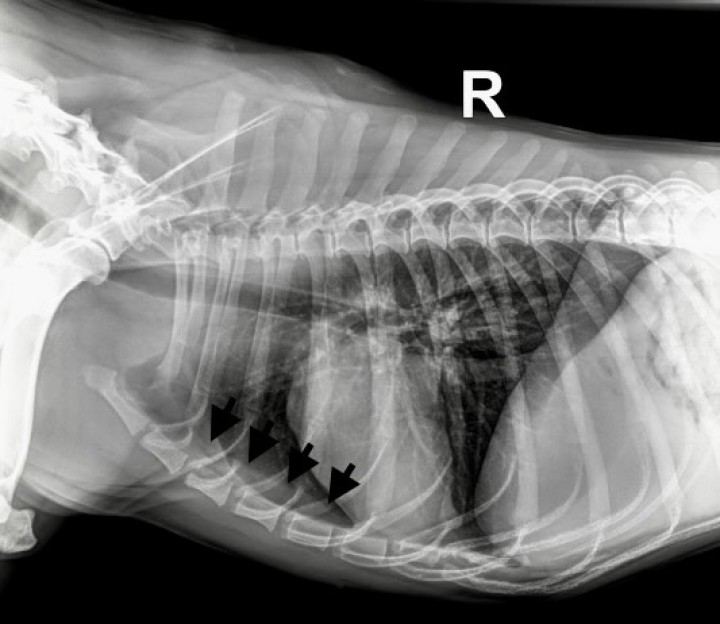
Una hembra mestiza de American bully, esterilizada de 2 años y 20 kg de peso fue remitida por un cuadro clínico de apatía, temblores, poliuria/polidipsia (PU/PD) e hiporexia de aproximadamente 3 semanas de evolución. Al examen físico, se auscultaron sonidos cardíacos disminuidos en el hemitórax craneal izquierdo. En el centro veterinario remisor se realizó una analítica sanguínea que mostraba valores elevados de creatinina (Crea), nitrógeno ureico (BUN) y calcio total (Ca). En el urianálisis obtenido mediante cistocentesis, se observó una gravedad específica de la orina (USG) de 1,015 y una ratio proteína creatinina (UPC) de 0,15 mg/dl (Tabla 1, día 1). La radiografía laterolateral derecha de tórax evidenció una estructura homogénea y ovalada con radiodensidad de tejido blando a nivel del mediastino craneoventral (Fig. 1).
En negrita aparecen los valores fuera de rango.
CREA: creatinina; BUN: nitrógeno ureico en la sangre; PHOS: fósforo; CA: calcio; ALB: albúmina; USG: gravedad específica de la orina; UPC: ratio proteína creatinina.
Figura 1
Radiografía laterolateral derecha de tórax. En la región ventral del mediastino craneal se evidencia una opacidad ovalada con densidad de tejidos blandos, que se extiende cranealmente hasta la primera costilla y caudalmente hasta el sexto espacio intercostal, desplazando caudalmente el corazón. Dorsalmente, la lesión se extiende ventral a las 4 primeras vértebras torácicas (flechas negras).
En base a los hallazgos clínicos, se consideraron los siguientes diagnósticos diferenciales:
- Enfermedad renal aguda o crónica por causa renal en estadio II, según los criterios de clasificación de la insuficiencia renal aguda o crónica IRIS. Las posibles causas incluyen isquemia renal, pielonefritis, neoplasia, nefrotoxinas.
- Hipercalcemia secundaria a síndrome paraneoplásico, hipoadrenocorticismo, enfermedad renal crónica, hiperparatiroidismo primario, hipervitaminosis D y algunas enfermedades granulomatosas.
- Masa mediastínica compatible con timo normal en animales jóvenes, neoplasia, linfadenomegalia esternal, quiste, absceso, granuloma, hematoma, dilatación esofágica por anomalía del anillo vascular, aneurisma de aurícula derecha.
Se instauró un tratamiento médico consistente en metilprednisolona (Urbason® 40 mg/ml, Sanofi, Anagni, Italia) a 1 mg/kg cada 12 horas por vía intravenosa (IV), maropitant (Prevomax® 10 mg/ml, Dechra, Badel, Países Bajos) a 1 mg/kg cada 24 horas IV, y suero salino fisiológico a 0,9 % (Braun®, 500 ml, Barcelona, España) a 4 ml/kg/h IV. Tras la mejoría del estado de hidratación del paciente y la disminución de la creatinina a un valor dentro del intervalo de referencia (Tabla 1, día 4), se realizaron pruebas diagnósticas adicionales, bajo el mismo procedimiento anestésico.
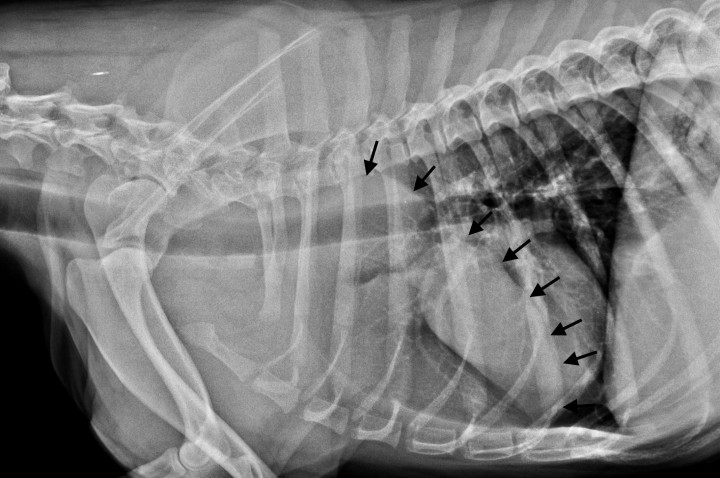
1. Tomografia computarizada (TC): se realizó un estudio de cuerpo completo, incluyendo imágenes pre y postcontraste intravenoso, procesadas con algoritmo de tejidos blandos y de pulmón, con espesor de cortes de 1 mm, donde se evidenció la presencia de una masa en el mediastino craneal, extendiéndose hacia el hemitórax izquierdo, con unas medidas de 16,6 cm de largo por 7 cm de ancho y 8,7 cm de alto. La lesión presentaba márgenes bien definidos, atenuación de tejidos blandos, realce leve y homogéneo. La lesión causaba un desplazamiento dorsolateral hacia la derecha de los principales vasos del mediastino craneal, y compresión moderada/severa de la vena cava craneal. La lesión se encontraba en contacto con el aspecto craneolateral izquierdo del corazón, que aparecía desplazado caudalmente y hacia el lado derecho por la masa mediastínica. Era también visible la retracción de los lóbulos pulmonares craneales, más evidente en el lado izquierdo, debido a la expansión de la lesión mediastínica (Fig. 2).
Figura 2
Imágenes de TC postcontraste en ventana de tejido blando de la masa en mediastino craneal, extendiéndose hacia el lado izquierdo del tórax. (A) Plano sagital. (B) Plano axial. (C) Plano coronal. Nótese el corazón desplazado en dirección caudal y hacia el lado derecho. M: masa; C: corazón.
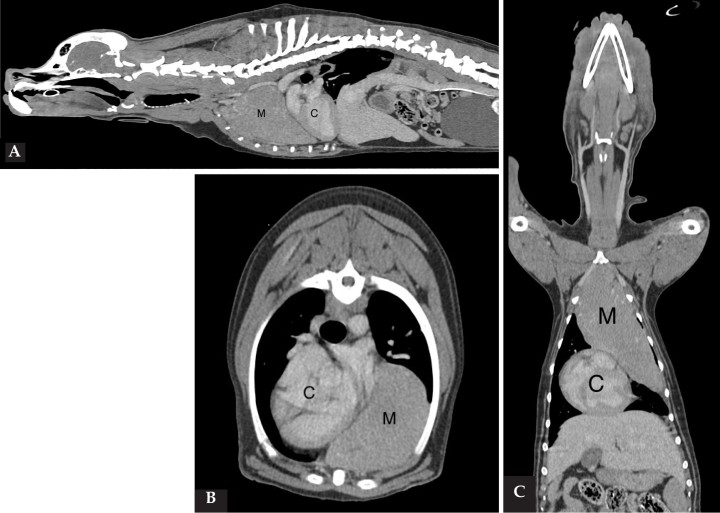
2. Punción con aguja fina ecoguiada de masa mediastínica: se observó una población densa y homogénea de células linfoides, predominantemente de tamaño intermedio, con núcleo redondeado o levemente ovoide, con cromatina grumosa y nucléolos prominentes. El citoplasma era escaso y de color azul intenso. También se observaron algunos macrófagos fagocitando restos celulares. El diagnóstico presuntivo fue compatible con linfoma mediastínico (Fig. 3).
Figura 3
Citología procedente de la masa mediastínica donde se observa una población homogénea de linfocitos intermedios. Tinción Diff-Quick®, Plössl (PL.) 10X/20mm dioptrías; x40.
3. Citometría de flujo: se realizaron múltiples punciones con aguja fina, sin aspiración, ecoguiadas de la masa mediastínica, intentando en la manera de lo posible evitar la hemocontaminación, y se depositaron las muestras obtenidas en tubos eppendorf con suero salino. El envío de la muestra se realizó de manera urgente en un recipiente de poliespán con una placa de hielo. Se adjuntó una extensión citológica.
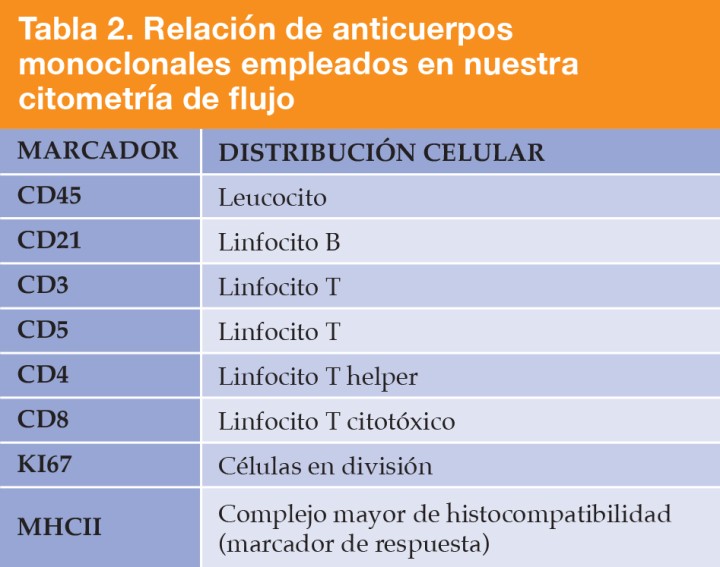
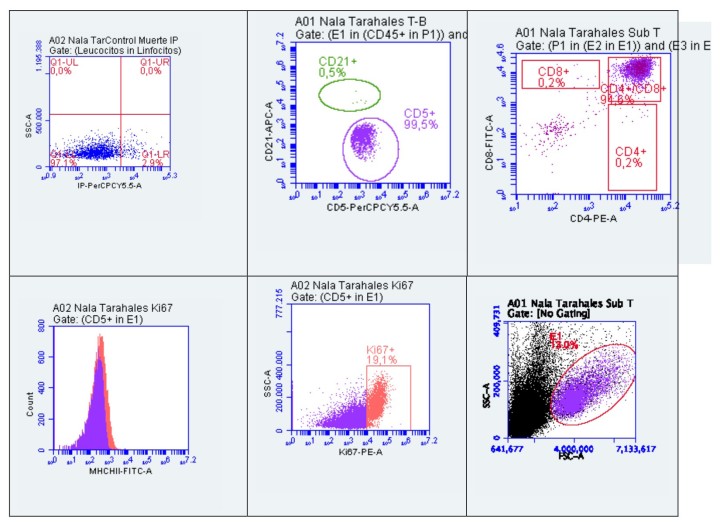
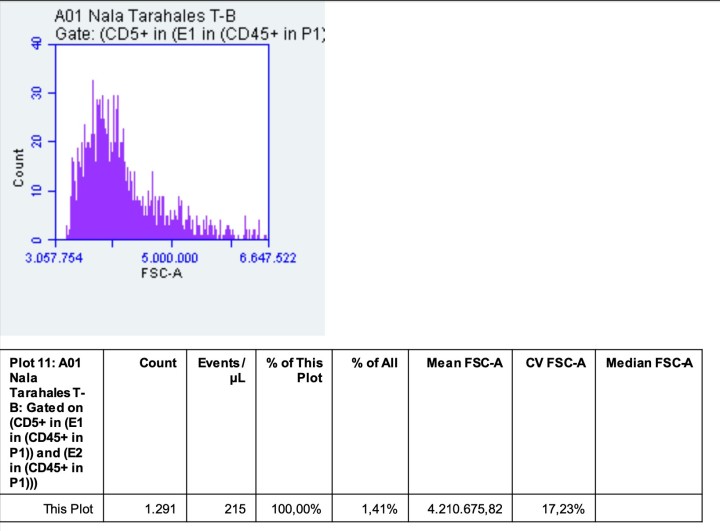
El análisis del inmunofenotipaje de la masa mediastínica utilizando los marcadores enumerados en la Tabla 2 reveló una población linfoide predominante de células T doble positivo CD4/CD8, representando el 94 % del total celular. Estas células T mostraban un tamaño anormalmente grande con un valor medio de 421x104 unidades de dispersión frontal (FSC). Los controles internos de calibración del laboratorio de referencia determinaron que los linfocitos sanos se encuentran en el rango de 200 x 104 FSC, mientras que los linfocitos reactivos oscilan entre 250-300 x 104 FSC. El porcentaje de linfocitos T con expresión Ki67 fue del 19,1 % (Figs. 4 y 5, Tabla 3).
Figura 4
Inmunofenotipado de la masa mediastínica por citometría de flujo. Histogramas y diagramas de puntos.
Figura 5
Análisis de dispersión frontal de linfocitos T: Histograma.
La interpretación se consideró no concluyente, compatible con timoma o linfoma de linfocitos CD4+CD8+, por lo que se recomendaron estudios de clonalidad adicionales (PARR).
4. PARR (PCR for Antigen Receptor Rearrangement): se realizó a partir de la muestra citológica obtenida inicialmente para su estudio microscópico, de donde se extrajo el ADN genómico y se procedió a la amplificación mediante PCR utilizando los oligonucleótidos correspondientes a la cadena gamma del receptor de células T y a las cadenas pesadas de las inmunoglobulinas. Los productos amplificados fueron analizados en un secuenciador automático, siendo el resultado monoclonal en receptores de linfocitos T. La certeza diagnóstica fue del 98 % (porcentaje aportado por el laboratorio de referencia).
El diagnóstico final fue de linfoma mediastínico de células T de alto grado y se inició un protocolo quimioterápico multifármaco a base de ciclofosfamida (Genoxal® 50 mg, Barcelona, España) a 200 mg/kg PO, doxorrubicina (Adriblastina® RD 50 mg, Pfizer, Milán, Italia) a 30 mg/m2 IV, vincristina (Vincristina® 1 mg/ml, Pfizer, Alcobendas, Madrid) a 0,7 mg/m2 IV y prednisona (Prednicortone® 20 mg, Dechra, Badel, Países Bajos) a 2 mg/kg PO (Protocolo CHOP) con una respuesta inicial excelente (Fig. 6).
Figura 6
Radiografía laterolateral derecha de tórax de control 15 días después de iniciado el tratamiento médico. En la región ventral del mediastino craneal se evidencia una opacidad ovalada de partes blandas, que se extiende cranealmente hasta la primera costilla y caudalmente hasta el 5 espacio intercostal. Nótese la considerable reducción de tamaño de la masa (flechas negras).
Tres semanas después, el paciente se presentó en consulta por presentar PU/PD, náuseas e hiporexia. Se realizó una bioquímica, observándose valores elevados de BUN, Crea y Ca (Tabla 1, día 22), los cuales se normalizaron tras 48 horas siguiendo el mismo tratamiento inicial (prednisolona, maropitant y fluidoterapia). Una semana más tarde acudió a consulta de urgencias por un cuadro clínico de incoordinación, temblores e hipersalivación. Se realizó una bioquímica en la cual destacaron nuevamente niveles elevados de BUN, Crea y Ca (Tabla 1, día 31). Debido al empeoramiento clínico del paciente y al pronóstico desfavorable de la enfermedad, se decidió practicar la eutanasia humanitaria.
Discusión
El linfoma mediastínico primario en perros se caracteriza por signos clínicos inespecíficos, un fenotipo de células T mayoritariamente con morfología linfoblástica, hipercalcemia y derrame pleural.1
La citometría de flujo (FC) se ha convertido en la técnica de rutina en la evaluación de las neoplasias hematopoyéticas. Aparte de la evaluación de sangre periférica, en la que la citometría de flujo es el método de elección, se está aplicando cada vez más como una técnica rápida y fiable para la determinación de antígenos de superficie y citoplasmáticos en células obtenidas de ganglios linfáticos y otras masas con sospecha de neoplasias hematolinfoides.
Dado que el mediastino craneal es un sitio frecuente de afectación por parte de tumores tanto primarios como secundarios, la citometría de flujo juega un papel importante en la evaluación de las masas mediastínicas.9
Según el estudio realizado por Lana et al. (2006), el hallazgo de un 10 % o más de linfocitos pequeños con el marcador CD4+CD8+ era criterio para el diagnóstico de timoma. Sin embargo, se reportó un caso aislado de timoma en el que los linfocitos carecían de la doble positividad de los marcadores CD4 y CD8, lo cual contradijo parcialmente los resultados previamente publicados.12 El análisis de citometría de flujo de los linfomas mediastínicos reveló una diversidad fenotípica en estos tumores; un subgrupo de estos linfomas expresó tanto CD4 como CD8 en más del 10 % de sus células. No obstante, se demostró que la dispersión frontal de estas células, que está relacionada con el tamaño celular, fue significativamente mayor en los linfomas en comparación con los timomas. Esta característica pudo ser utilizada como un indicador para diferenciar entre ambos tipos de tumores.
Además de la dispersión frontal, se encontró que el análisis de clonalidad a través del análisis PARR también podía contribuir al diagnóstico. Las poblaciones de linfocitos clonales fueron características de los linfomas y raramente se encontraron en los timomas. En un estudio retrospectivo, se identificó una población linfoide monoclonal de células T en el 7,7 % de las muestras de pacientes con timoma.13
En este caso en particular, los resultados mostraron una población linfoide predominante de células T (CD45+/CD21-/CD5+/CD3+), la cual en su mayoría (94 %) expresaban tanto CD4 como CD8. Estas células también presentaban un tamaño anormalmente grande, con un promedio de 421 x 104 FSC, en contraste con el rango promedio para linfocitos no tumorales que es de 200-300 x 104 FSC. Estas características fueron consistentes con un diagnóstico de linfoma mediastínico. Sin embargo, para confirmar, se llevó a cabo una prueba de clonalidad que resultó en la identificación de una población monoclonal en los receptores de linfocitos T.
La determinación por citometría de flujo de Ki67, antígeno nuclear, refleja significativamente el grado de malignidad del linfoma canino, independientemente del fenotipo y la morfología, permitiendo diferenciar los linfomas de alto grado de los de bajo grado. Esto podría ser útil para resolver problemas de diagnóstico y predecir la transformación de linfoma de bajo grado en formas más agresivas. Los linfomas de alto grado mostraban un Ki67 significativamente más alto en comparación con los linfomas de bajo grado (valor de corte de 12,2 %).14
La obtención y preparación adecuada de las muestras es fundamental para el uso efectivo de la citometría de flujo. Es fundamental manipular las muestras con cuidado para maximizar la viabilidad celular y minimizar los artefactos, como la contaminación con sangre periférica. Ambas situaciones podrían provocar que nuestra muestra no pudiera ser evaluada (muestra insuficiente o un alto porcentaje de células muertas) u obtener un resultado falso negativo debido a la contaminación con sangre (disminución relativa del porcentaje de linfocitos). Se recomienda encarecidamente consultar las directrices publicadas por el laboratorio de referencia. En cuanto a las ventajas del uso de la citometría, destaca la facilidad para la obtención de muestras y que proporciona información de importancia diagnóstica, terapéutica y pronóstica de manera rápida. Por el contrario, presenta una serie de limitaciones, como la necesidad de que la muestra sea fresca, y su limitada utilidad cuando la presencia de células neoplásicas es escasa.11
El examen citológico mediante punción con aguja fina (PAF) de los nódulos linfáticos u otros tejidos afectados es un paso diagnóstico de primera línea o de detección altamente sensible y específico. En algunas formas de linfoma predominan los linfocitos intermedios; estas muestras pueden ser desafiantes para un citopatólogo sin experiencia. El uso de técnicas de diagnóstico molecular como la inmunofenotipificación mediante citometría de flujo y pruebas de clonalidad como la PARR, para confirmar y caracterizar el tumor, están mostrando potencial de utilidad tanto para el diagnóstico como para el pronóstico.15
En el caso aquí expuesto, si bien la citología era muy sugestiva de linfoma mediastínico, se recomendó continuar con las pruebas diagnósticas con el fin de confirmar el diagnóstico y tipificar el tumor.
El inmunofenotipo ha demostrado ser el factor pronóstico más significativo, junto con el estadio y subestadio, para los perros con linfoma canino y nos puede orientar en la elección del tipo de tratamiento.16-18 En el caso de perros con linfoma no indolente de células T, tratados con el mismo protocolo, se ha observado que tienen menor probabilidad de alcanzar una remisión completa (RC) y presentan una duración de la remisión y un tiempo de supervivencia general (OST) significativamente más cortos en comparación con aquellos con linfoma de células B.19-21 A pesar de estas diferencias, los protocolos de quimioterapia actuales no se adaptan rutinariamente al inmunofenotipo del linfoma.22-26 De hecho, un estudio reveló que solo el 31 % de los oncólogos veterinarios utilizaban protocolos de tratamiento diferentes para perros con linfoma de células T en comparación con aquellos con linfoma de células B.27
En un estudio retrospectivo, se analizó el tratamiento de perros con linfoma de células T utilizando un protocolo que incluye L-asparaginasa, mecloretamina, prednisona, procarbazina y vincristina (L-MOPP). Los resultados mostraron una tasa de respuesta completa (RC) del 78 % y una mediana de supervivencia libre de progresión (PFS) de 189 días, superiores a los datos históricos de perros tratados con el protocolo CHOP.28
En otro estudio retrospectivo que examinó el uso del protocolo CHOP en perros con linfoma de células T, se encontró una tasa más alta de RC del 88 %. Sin embargo, el período de PFS fue más corto, alcanzando los 104 días,4 en comparación con un estudio similar donde solo el 40 % de los perros con linfoma de células T tratados con CHOP lograron RC, con una mediana de PFS de 105 días.21
Un estudio más reciente, que incluyó un número más amplio de perros con linfoma de células T, evaluó el uso del protocolo VELCAP-SC, que consiste en vincristina, L-asparaginasa, ciclofosfamida, lomustina (CCNU), doxorrubicina, prednisolona, procarbazina y mecloretamina. En este estudio, se observó una tasa de respuesta completa (CR) del 64 % y una mediana de supervivencia libre de progresión (PFS) de 175 días.29
En otro estudio retrospectivo de perros diagnosticados de linfoma mediastínico primario, 4 casos fueron tratados con una combinación de radioterapia (RT) y quimioterapia basada en CHOP; uno de los casos obtuvo una PFS de 281 días y una supervivencia general (OS) de 352 días, mientras que en otro caso no se observó recaída documentada. Se necesita más investigación sobre el papel de la RT en el tratamiento de perros con linfoma mediastínico primario para comprender mejor el impacto potencial en el resultado del paciente.1
En nuestro caso, si bien se obtuvo inicialmente una respuesta completa, no se alcanzaron los tiempos medios de supervivencia descritos en los estudios mencionados. Se desconoce si el uso de corticoesteroides durante la estabilización del paciente pudo desencadenar mecanismos de resistencia a los medicamentos (doxorrubicina, vincristina) y ser la causa de una respuesta tan corta.30
Agradecimientos
Los autores quieren agradecer al Dr. Víctor Domingo Roa (Atypia: Oncología veterinaria y experimental) y a Pablo Cigüeña del Ojo (Onkos: Citología diagnóstica veterinaria y oncología clínica) por su asesoramiento.
Fuente de financiación: este trabajo no se realizó con fondos comerciales, públicos o del sector privado.
Conflicto de intereses: los autores declaran que no existen conflicto de intereses.
Bibliografía
- 1.
Moore L, Vernau W, Rebhun R, Skorupski K, Burton J. Patient characteristics, prognostic factors and outcome of dogs with high-grade primary mediastinal lymphoma. Vet Comp Oncol 2018; 16(1): E45-E51.
[PubMed] - 2.
Geyer NE, Reichle JK, Valdes-Martinez A, et al. Radiographic appearance of confirmed pulmonary lymphoma in cats and dogs. Vet Radiol Ultrasound 2010; 51(4): 386-390.
[PubMed] - 3.
Starrak GS, Berry CR, Page RL, Johnson JL, Thrall DE. Correlation between thoracic radiographic changes and remission/survival duration in 270 dogs with lymphosarcoma. Vet Radiol Ultrasound 1997; 38(6): 411-418.
[PubMed] - 4.
Rebhun RB, Kent MS, Borrofka SA, et al. CHOP chemotherapy for the treatment of canine multicentric T-cell lymphoma. Vet Comp Oncol 2011; 9(1): 38-44.
[PubMed] - 5.
Avery PR, Burton J, Bromberek JL, et al. Flow cytometric characterization and clinical outcome of CD4+ T-cell lymphoma in dogs: 67 cases. J Vet Intern Med 2014; 28(2): 538-546.
[PubMed] - 6.
Villamil JA, Henry CJ, Hahn AW, et al. Hormonal and sex impact on the epidemiology of canine lymphoma. J Cancer Epidemiol 2009; 2009:591753.
[PubMed] - 7.
Yoon J, Feeney DA, Cronk DE, Anderson K, Ziegler L. Computed tomographic evaluation of canine and feline mediastinal masses in 14 patients. Vet Radiol Ultrasound 2004; 45: 542-546.
[PubMed] - 8.
Day MJ. Review of thymic pathology in 30 cats and 36 dogs. J Small Animal Practice 1997; 38: 393-403.
[PubMed] - 9.
Lana S, Plaza S, Hampe K, Burnett R, Avery A. Diagnosis of Mediastinal Masses in Dogs by Flow Cytometry. J Vet Intern Med 2006; 20: 1161-1165.
[PubMed] - 10.
Comazzi S, Riondato F. Flow Cytometry in the Diagnosis of Canine T-Cell Lymphoma. Front Vet Sci 2021; 8: 600963.
[PubMed] - 11.
Evans SJM. Flow Cytometry in Veterinary Practice. Vet Clin North Am Small Anim Pract 2023; 53(1): 89-100.
[PubMed] - 12.
Wikander YM, Knights K, Coffee C, et al., CD4 and CD8 double-negative immunophenotype of thymoma-associated lymphocytes in a dog. J Vet Diagn Invest 2020; 32(6): 918-922.
[PubMed] - 13.
Vessieres F, Rasotto R, Peters I, et al. Assessment of Lymphoid Molecular Clonality in Canine Thymoma. J Comp Pathol 2018; 158: 66-70
[PubMed] - 14.
Poggi A, Miniscalco1 B, Morello E, et al. Flow cytometric evaluation of ki67 for the determination of malignancy grade in canine lymphoma. Vet Comp Oncol 2015; 13(4): 475-80.
[PubMed] - 15.
David M, Marie P, Karen M: Tumores hematopoyéticos. EN Withrow y MacEwen (ed): Oncología Clínica de Pequeños Animales, Missouri, Elsevier, 2020; 518-582.
- 16.
Baskin CR, Couto CG, Wittum TE. Factors influencing first remission and survival in 145 dogs with lymphoma: A retrospective study. J Am Animal Hosp Assoc 2000; 36: 404-409.
[PubMed] - 17.
Fournel-Fleury C, Ponce F, Felman P, et al. Canine T-cell lymphomas: A morphological, immunological, and clinical study of 46 new cases. Vet Pathol 2002; 39(1): 92-109.
[PubMed] - 18.
Ponce F, Magnol JP, Ledieu D, et al. Prognostic significance of morphological subtypes in canine malignant lymphomas during chemotherapy. Vet J 2004; 167(2):158-66.
[PubMed] - 19.
Teske E, van Heerde P, Rutteman GR, et al. Prognostic factors for treatment of malignant lymphoma in dogs. J Am Vet Med Assoc 1994; 205(12): 1722-1728.
[PubMed] - 20.
Chun R, Garrett LD, Vail DM. Evaluation of a high-dose chemotherapy protocol with no maintenance therapy for dogs with lymphoma. J Vet Intern Med 2000; 14(2): 120-124.
[PubMed] - 21.
Curran K, Thamm DH. Retrospective analysis for treatment of naive canine multicentric lymphoma with a 15-week, maintenance-free CHOP protocol. Vet Comp Oncol 2016; 14 Suppl 1: 147-155.
[PubMed] - 22.
Moore AS, Cotter SM, Rand WM, et al. Evaluation of a discontinuous treatment protocol (VELCAP-S) for canine lymphoma. J Vet Intern Med 2001; 15(4): 348-354.
[PubMed] - 23.
Garrett LD, Thamm DH, Chun R, Dudley R, Vail DM. Evaluation of a 6-month chemotherapy protocol with no maintenance therapy for dogs with lymphoma. J Vet Intern Med 2002; 16(6): 704-709.
[PubMed] - 24.
Morrison-Collister KE, Rassnick KM, Northrup NC, et al. A combination chemotherapy protocol with MOPP and CCNU consolidation (Tufts VELCAP-SC) for the treatment of canine lymphoma. Vet Comp Oncol 2003; 1(4): 180-190.
[PubMed] - 25.
Simon D, Nolte I, Eberle N, et al. Treatment of dogs with lymphoma using a 12-week, maintenance-free combination chemotherapy protocol. J Vet Intern Med 2006; 20(4): 948-954.
[PubMed] - 26.
Rassnick KM, Bailey DB, Malone EK, et al. Comparison between L-CHOP and an L-CHOP protocol with interposed treatments of CCNU and MOPP (LCHOP-CCNU-MOPP) for lymphoma in dogs. Vet Comp Oncol 2010; 8(4): 243-253.
[PubMed] - 27.
Regan RC, Kaplan MS, Bailey DB. Diagnostic evaluation and treatment recommendations for dogs with substage-a high-grade multicentric lymphoma: Results of a survey of veterinarians. Vet Comp Oncol 2013; 11(4): 287-295.
[PubMed] - 28.
Brodsky EM, Maudlin GN, Lachowicz JL, Post GS. Asparaginase and MOPP treatment of dogs with lymphoma. J Vet Intern Med 2009; 23(3): 578-584.
[PubMed] - 29.
Goodman IH, Moore AS, Frimberger AE. Treatment of canine non-indolent T cell lymphoma using the VELCAP-TSC protocol: A retrospective evaluation of 70 dogs (2003-2013). Vet J 2016; 211: 39-44.
[PubMed] - 30.
Zandvliet M, Teske E. Mechanisms of Drug Resistance in Veterinary Oncology- A Review with an Emphasis on Canine Lymphoma. Vet Sci 2015; 2(3).
[PubMed]