Diagnóstico por imagen de una malformación arteriovenosa hepática en un perro
Diagnostic imaging of a hepatic arteriovenous malformation in a dog
V. Silva-Utrera, E. López-Medina, M. Labayru-Prats, B. Martínez-Gallego-Largo, H. Fominaya-García
Contacto: silvautreravanesa@gmail.com
Resumen
En el presente caso se describen los hallazgos ecográficos y de tomografía computarizada de una perra con una malformación arteriovenosa hepática (MAVH), una patología poco frecuente en la clínica de pequeños animales. Se presentó en la consulta una perra de 4 meses de edad remitida por distensión abdominal, diarreas y anorexia de tres semanas de evolución. La exploración física mostró una onda ascítica marcada. Mediante el uso de la ecografía abdominal se evidenció una gran cantidad de líquido libre abdominal, edematización del páncreas y microhepatía. También se observó la arterialización del sistema venoso portal con un flujo pulsátil y hepatófugo, la existencia de hipertensión portal, así como la existencia de comunicaciones portosistémicas extrahepáticas adquiridas. Los hallazgos fueron compatibles con una malformación arteriovenosa hepática (MAVH). La Tomografía Computarizada permitió un estudio más exhaustivo de la vascularización hepática y de las comunicaciones portosistémicas extrahepáticas adquiridas. Dado el mal pronóstico quirúrgico, se estableció un tratamiento sintomático y, en la actualidad, la paciente permanece estable.
Palabras clave: malformación arteriovenosa hepática, hipertensión portal, comunicaciones portosistémicas extrahepáticas, ultrasonografía, tomografía computarizada.
Clin Vet Peq Anim 2019, 39 (4): 229- 234
Summary
In the present report, ultrasonographic and computed tomography findings of a female dog with hepatic arteriovenous malformation (MAVH) are described. This condition is an uncommon pathology in small animals. A 4-months old female dog was referred for abdominal distension, diarrhea and anorexia of three weeks. Physical examination showed a marked ascitic wave. Abdominal ultrasound confirmed the presence of a large amount of free abdominal fluid, edematization of the pancreas and microhepathy. Arterialization of the portal venous system with a pulsatile and hepatofugal flow, existence of portal hypertension and the existence of acquired extrahepatic portosystemic communications was also observed. These findings were compatible with hepatic arteriovenous malformation (MAVH). Computed Tomography allowed a more thorough study of the hepatic vascularization and of the acquired extrahepatic portosystemic communications. Given the poor surgical prognosis, the patient was prescribed symptomatic treatment and remains stable at present.
Keywords: hepatic arteriovenous malformation, portal hypertension, extrahepatic portosystemic communications, ultrasonography, computed tomography.
Clin Vet Peq Anim 2019, 39 (4): 229- 234

La presencia de este logo en un artículo de la revista indica que se publicará un examen sobre el mismo en la plataforma AVEPA Elearning. Su resolución aporta 0,15 créditos dentro del sistema de acreditaciones de especialidades veterinarias de AVEPA.
Introducción
La malformación arteriovenosa hepática (MAVH) es una derivación vascular anormal entre la(s) arteria(s) hepática(s) y las ramas portales intrahepáticas que representa una causa poco frecuente de hipertensión portal presinusoidal en pequeños animales.1 La alta presión de la arteria hepática hace que el flujo se invierta no sólo en la rama de la vena porta del lóbulo afectado, sino también en la vena porta principal.2 La incidencia de MAVH es baja en perros, y su presentación es extremadamente rara en gatos.1
Esta afección puede tener un origen congénito o adquirido. En perros y gatos la mayoría de las MAVH son congénitas, probablemente por el fracaso del plexo capilar embriológico común al diferenciarse en arteria o vena.3 Las MAVH adquiridas se originan secundariamente a un traumatismo abdominal, cirugía del hígado, neoplasia hepática, cirrosis o ruptura de un aneurisma de la arteria hepática.4
En el presente trabajo se describen los hallazgos ecográficos y de tomografía computarizada (TC) en una perra de 4 meses de edad con una malformación arteriovenosa hepática.
Caso clínico
Una perra de raza mestiza, hembra entera, de 4 meses de edad, es remitida al hospital con historial de distensión abdominal, diarreas y anorexia de tres semanas de evolución.
La exploración física reveló una onda ascítica marcada, siendo su condición corporal buena y presentando un tamaño adecuado para su edad.
La analítica sanguínea mostró una ligera anemia con un hematocrito del 36 % (37,3-61,7), leucocitosis 32,47 x 103/μl (5,05-16,76), neutrofilia 21,12 x 103/μl (2,95-11,64), linfocitosis 6,61 x 103/μl (1,05-5,10), monocitosis 3,77 x 103/μl (0,16-1,12), proteínas totales disminuidas 4,1 g/dl (4,8-7,2), hipoalbuminemia 1,7 g/dl (2,1-3,6), ALT elevada 588 U/l (8-75), glucosa disminuida 72 mg/dl (77-150) y creatinina disminuida 0,2 mg/dl (0,3-1,2).
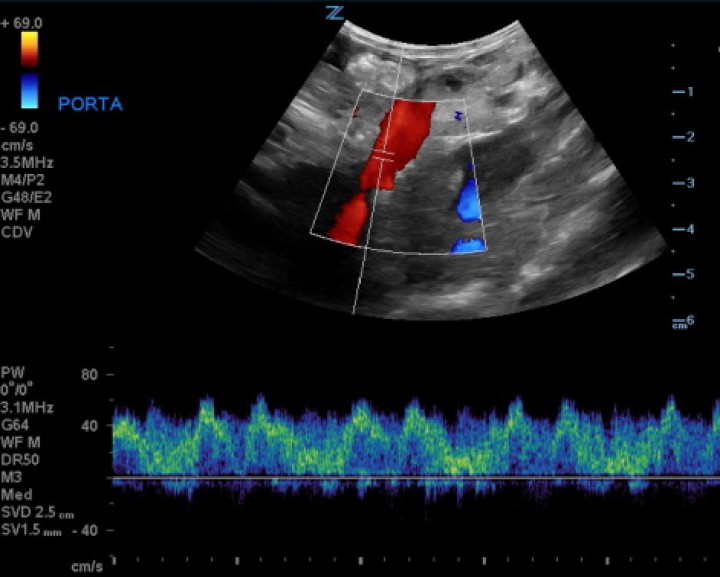
La ecografía abdominal, realizada bajo sedación del paciente y con sonda convexa de 3-9 MHz y lineal de 5-14 MHz (Z.One ultra, ZONARE, Mountain View, CA, EE.UU), evidenció que la vena porta principal a su entrada en el hígado presentaba un flujo unidireccional, pulsátil e invertido (hepatófugo), con velocidad portal de 57 cm/s (Fig. 1), lo que provocaba hipertensión portal y ascitis severa. Además, se observaba una estructura tubular anecoica que comunicaba con la vena porta intrahepática en el lóbulo hepático izquierdo (Fig. 2). Se apreció también una reducción del tamaño del parénquima hepático, de bordes irregulares. Múltiples vasos tortuosos fueron evidenciados caudomedial y lateral al riñón izquierdo (Fig. 3). El páncreas se encontraba aumentado de volumen con parénquima normoecoico y estriado, compatible con una edematización de la glándula (Fig. 4).
Figura 1
Imagen ecográfica en un corte longitudinal de la paciente con Doppler color y pulsado. Se observa un flujo pulsátil e invertido (hepatógufo) de la vena porta principal.
Figura 2
Imagen ecográfica en un corte transversal donde se observa una estructura tubular anecoica en el lóbulo izquierdo hepático en relación con la vena porta intrahepática (flechas).
Figura 3
Imagen ecográfica en un corte transversal de la paciente con Doppler color donde se observan múltiples vasos anómalos y tortuosos caudomedial al riñón izquierdo (rectángulo).
Figura 4
Imagen ecográfica en un corte transversal de la paciente donde se observa el lóbulo pancreático derecho aumentado de volumen con presencia de estrías hipoecoicas compatible con una edematización de la glándula (flechas). Presencia de líquido libre abdominal (*).
Basándose en estos hallazgos se estableció un diagnóstico presuntivo de malformación arteriovenosa hepática con múltiples comunicaciones vasculares portosistémicas extrahepáticas adquiridas, siendo necesaria la realización de una tomografía computarizada para su caracterización definitiva.
Se realizó una tomografía del abdomen con un escáner helicoidal de 16 cortes (Astelion, Toshiba, Japón). Se adquirieron imágenes previas y posteriores a la administración de contraste intravenoso iodado a una dosis de 600 mg/kg (Omnipaque®, GE Healthcare, Madrid) mediante inyección manual. El estudio postcontraste se adquirió a los 40 segundos de la administración del mismo.
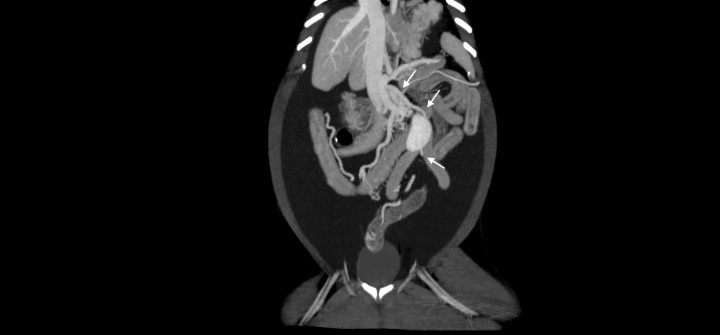
La TC reveló una microhepatía asimétrica, con los lóbulos hepáticos izquierdos de menor tamaño que los derechos y focos de mineralización distrófica, un gran volumen de efusión abdominal (Fig. 5) y edema de páncreas. El tronco celíaco se encontraba anormalmente dilatado y la aorta abdominal caudal a éste disminuida de tamaño (Fig. 6).
Figura 5
Imagen de tomografía computarizada dorsal tras la administración de contraste intravenoso, ventana de tejido blando. Se observa una microhepatía asimétrica con los lóbulos hepáticos izquierdos de menor tamaño que los derechos (flechas negras) y foco de mineralización distrófica en el parénquima hepático (flecha blanca). Presencia de gran cantidad de líquido libre abdominal (*).
Figura 6
Imagen de tomografía computarizada sagital tras la administración de contraste intravenoso, ventana de tejido blando. Se observa el tronco celíaco dilatado (flecha negra) con disminución del tamaño de la aorta abdominal caudal al mismo (flecha roja). Aorta abdominal craneal al tronco celíaco (flecha verde).
A partir de las ramas de la arteria hepática principal se observó un plexo de vasos tortuosos que desembocaban en dos ramas portales: en una rama intrahepática en el lóbulo medial izquierdo, craneoventral y adyacente al diafragma, resultando en una rama portal anormalmente dilatada y tortuosa (Fig. 7A); y en la propia rama portal tortuosa y aumentada de tamaño a partir de dos arteriolas hepáticas que nacían desde el lado derecho de la arteria hepática (Fig. 7B).
Figura 7
Imágenes de tomografía computarizada transversales tras la administración de contraste intravenoso, ventana de tejido blando. (A) Se observa la rama portal intrahepática en lóbulo medial izquierdo anormalmente dilatada y tortuosa (flechas). (B) Se aprecian vasos tortuosos (flechas) que drenan en la vena porta tortuosa y aumentada de tamaño.
De manera secundaria se detectaron comunicaciones portosistémicas extrahepáticas adquiridas:
- Vasos tortuosos localizados en la curvatura menor del estómago que se dirigían hacia craneal a través del hiato esofágico y paralelos al esófago compatibles con varices gastroesofágicas (Fig. 8A), mientras que otros vasos se dirigían hacia medial para desembocar en la vena cava caudal a través de la vena frénica izquierda consistente con varices gastrofrénicas (Fig. 8B).
Figura 8
Imágenes de tomografía computarizada transversales tras la administración de contraste intravenoso, ventana de tejido blando. (A) Se observa la presencia de varices gastroesofágicas (flecha). (B) Se observa la presencia de varices gastrofrénicas (flechas).
- Desde la vena esplénica, un vaso anómalo y aberrante, caudal y medial al riñón izquierdo, con la confluencia de otros vasos de menor calibre, era consistente con una comunicación esplenorrenal (Fig. 9A). También se observó la presencia de un vaso anómalo y tortuoso que partía de la vena pancreatoduodenal con dirección hacia caudal para terminar en la vena mesentérica caudal (Fig. 9B).
Figura 9
Imágenes de tomografía computarizada dorsales tras la administración de contraste intravenoso, ventana de tejido blando y con proyección de máxima intensidad (MIP) con sumatorio de cortes. (A) Se observa un vaso anómalo a partir de la vena esplénica que se dirige hacia caudal y medial del riñón izquierdo (flechas). (B) Se aprecia un vaso anómalo a partir de la vena pancreaticoduodenal (flechas blancas) que desemboca en la vena mesentérica caudal (flecha negra).
- Un vaso anormalmente dilatado y tortuoso a partir de la propia porta, justo caudal a la rama esplénica, con dirección hacia caudal por el abdomen izquierdo y lateral al riñón izquierdo, para dejar de ser visualizado a nivel del recto (Fig. 10).
Figura 10
Imagen de tomografía computarizada dorsal tras la administración de contraste intravenoso, ventana de tejido blando y con proyección de máxima intensidad (MIP) con sumatorio de cortes. Se observa a partir de la vena porta un vaso que se dirige hacia caudal por el lado izquierdo del abdomen y lateral al riñón izquierdo para dejar de ser visualizado a nivel del recto (flechas).
- Múltiples vasos tortuosos a nivel del abdomen central distribuidos por el resto del peritoneo de difícil caracterización (Fig. 11).
Figura 11
Imagen tomográfica transversal tras la administración de contraste intravenoso, ventana de tejido blando y con proyección de máxima intensidad (MIP) con sumatorio de cortes. Se observan múltiples vasos tortuosos a nivel del abdomen central (flechas).
Dado el mal pronóstico quirúrgico se estableció un tratamiento con furosemida a dosis de 0,5 mg/kg/12 h vía oral (Seguril®, Sanofi-aventis, S.A., Madrid) y metronidazol a una dosis de 7,5 mg/kg BID (Flagyl®, Sanofi-aventis, S.A., Barcelona). En la actualidad, tras un año de tratamiento médico con furosemida a la dosis citada, el estado del paciente permanece estable.
Discusión
El presente estudio describe los hallazgos ecográficos y de tomografía computarizada de una perra con malformación arteriovenosa hepática, que presentaba afectación de las arteriolas hepáticas y múltiples comunicaciones portosistémicas extrahepáticas adquiridas, entre ellas varices gastrofrénicas y gastroesofágicas.
Las fístulas arteriovenosas y las malformaciones arteriovenosas son anomalías de alto flujo que contienen componentes arteriales en combinación con otras estructuras vasculares. Las fístulas arteriovenosas tienen una conexión directa entre la arteria y la vena sin ninguna red vascular intermedia, mientras que las malformaciones arteriovenosas tienen una red densa de vasos anormales que representan la comunicación arteriovenosa llamada “nidus”.5
En la MAVH, la alta presión del flujo sanguíneo causa dilatación de las venas portales y, consecuentemente, una hipertensión portal. La formación de múltiples comunicaciones portosistémicas extrahepáticas adquiridas son secundarias al flujo hepatófugo y a la hipertensión portal.4 Esta hipertensión portal mantenida en el tiempo provoca la presencia de ascitis.6
Las varices se definen como pequeños vasos colaterales portales, múltiples y tortuosos. En humanos, las varices han sido descritas mediante angiografía por TC como estructuras bien definidas, tubulares o sinusoides, con atenuación homogénea y con la misma captación de contraste que los vasos adyacentes. Estas varices se clasifican en función de si drenan en la vena cava superior o en la vena cava inferior.7 En nuestro caso, al igual que en el estudio previo de Bertolini (2010), las varices gástricas drenaban en la vena cava craneal a través de las venas esofágica o paraesofágica (varices gastroesofágicas) o en la vena cava caudal mediante la vena frenicoabdominal izquierda (varices gastrofrénicas).7
Al igual que en estudios previos,5 se pudo evidenciar la presencia de una microhepatía evidente causada, presumiblemente, por la disminución de sangre que llegaba a los hepatocitos a causa del “fenómeno de robo de sangre” en la arteria hepática y a la hipertensión portal con flujo hepatófugo. Con el “fenómeno de robo de sangre”, la sangre arterial obvia los capilares arteriales, aportando una cantidad reducida de oxígeno a los hepatocitos. También provoca una disminución del flujo sanguíneo en las arterias adyacentes a la comunicación arterioportal, lo cual explica la disminución abrupta del diámetro de la aorta, ya descritos anteriormente por Zwingenberger et al.5
En el presente caso, la ecografía abdominal fue de gran utilidad para el diagnóstico de la MAVH, ya que confirmó la arterialización del sistema venoso portal con un flujo pulsátil y hepatófugo, y la existencia de hipertensión portal y comunicaciones portosistémicas extrahepáticas adquiridas, no siendo posible su caracterización. Sin embargo, la TC permitió un estudio más exhaustivo de la vascularización hepática y aportó información detallada de las derivaciones portosistémicas extrahepáticas adquiridas, así como del diámetro de la aorta caudal al tronco celíaco. La técnica para su diagnóstico es la angiografía por TC en fase dual. Durante la fase arterial se visualiza el llenado de las venas portas y el flujo hepatófugo portal.8 Aunque en el presente caso fue realizada en fase venosa únicamente, no significó una limitación diagnóstica.
En conclusión, la malformación arteriovenosa hepática (MAVH), a pesar de ser una patología poco frecuente en perros y gatos, debe ser considerada en la lista de diagnósticos diferenciales en animales con ascitis.
Fuente de financiación: este trabajo no se realizó con fondos comerciales, públicos o del sector privado.
Conflicto de intereses: los autores declaran que no existen conflictos de intereses.
Bibliografía
- 1.
Uemura A, Haruyama T, Nakata M et al. Hybrid technique coil embolisation for intrahepatic arterioportal fistula in a cat: case report. J Feline Med and Surg Open Rep. 2016 7; 2 (1): 2055116916642256.
[PMC] - 2.
Szatmári V, Németh T, Kótai I, Vörös K, Sótonyi P. Doppler ultrasonographic diagnosis and anatomy of congenital intrahepatic arterioportal fistula in a puppy. Vet Radiol Ultrasound 2000, 41 (3):284-6.
[PubMed] - 3.
Chanoit G, Kyles AE, Weisse C, Hardie EM. Surgical and interventional radiographic treatment of dogs with hepatic arteriovenous fistulae. Vet Surg. 2007; 36 (3):199-209.
[PubMed] - 4.
Johnson ES, Sherding GR: Diseases of the liver and biliary tract. En Stephen J. Birchard; Robert G. Shering (ed): Saunders Manual of Small Animal Practice, Third Edition, USA, Saunders; 2006;795-6.
- 5.
Specchi S, Rossi F, Weisse C et al. Canine and feline abdominal arterioportal communications can be classified based on branching patterns in computed tomographic angiography. Vet Radiol Ultrasound 2018; 59 (6):687-696.
[PubMed] - 6.
McConnell JF, Sparkes AH, Ladlow J, Doust R, Davies S: Ultrasonographic diagnosis of unusual portal vascular abnormalities in two cats. J Small Anim Pract 2006; 47(6): 338-43.
[PubMed] - 7.
Bertolini G: Acquired portal collateral circulation in the dog and cat. Vet Radiol Ultrasound 2010; 51(1):25-33.
[PubMed] - 8.
Zwingenberger AL, MclearRC, Weisse C: Diagnosis of arterioportal fistulae in four dogs using computed tomographic angiography. Vet Radiol Ultrasound 2005; 46: 472-477.
[PubMed]