Aislamiento de Pseudomonas aeruginosa a partir de líquido ascítico en un gato con carcinoma pancreático avanzado y carcinomatosis peritoneal
Isolation of Pseudomonas aeruginosa from ascitic fluid in a cat with advanced pancreatic carcinoma and peritoneal carcinomatosis
L. Magen-Moreno, D. Borràs-Murcia, G. Doria-Torra
Contacto: elkau.mascotes@gmail.com
Resumen
Las neoplasias pancreáticas son infrecuentes en gatos, apareciendo en animales de edad avanzada. La carcinomatosis peritoneal constituye un estadío avanzado de ciertas neoplasias epiteliales malignas (abdominales, cutáneas, mamarias, etc.), entre ellos el páncreas, caracterizándose por la diseminación intraabdominal de células tumorales que pueden originar múltiples nódulos sobre serosas. En fases avanzadas de la enfermedad puede aparecer efusión peritoneal de naturaleza estéril. En medicina humana el término bacteriascitis hace referencia al aislamiento de microorganismos patógenos a partir de líquido ascítico de características estériles y se considera una fase previa al desarrollo de peritonitis bacteriana secundaria. El presente trabajo describe el aislamiento de Pseudomonas aeruginosa a partir de líquido ascítico de un gato con diagnóstico de carcinoma pancreático avanzado y carcinomatosis peritoneal.
Palabras clave: carcinomatosis, carcinoma pancreático felino, peritonitis séptica, ascitis, Pseudomonas aeruginosa.
Clin Vet Peq Anim 2023, 43 (2): 83-89
Summary
Pancreatic neoplasms are rare in cats, and they are diagnosed in aged animals. Peritoneal carcinomatosis is an advanced stage of certain epitelial malignant tumors with different origin, abdominal, cutaneous, mammary, including pancreas among others. Advanced pancreatic tumors are characterized by intra-abdominal spread of tumor cells forming multiple nodules on serosal surfaces. Sterile peritoneal effusion can appear in advanced phases of the disease. In human medicine the term bacterascites makes reference to the isolation of pathogenic microorganisms in sterile ascitic fluid and can evolve to secondary bacterial peritonitis. This article describes the isolation of Pseudomonas aeruginosa in ascitic fluid of a cat diagnosed with an advanced pancreatic carcinoma and peritoneal carcinomatosis.
Keywords: carcinomatosis, feline pancreatic carcinoma, septic peritonitis, ascites, Pseudomonas aeruginosa.
Clin Vet Peq Anim 2023, 43 (2): 83-89

La presencia de este logo en un artículo de la revista indica que se publicará un examen sobre el mismo en la plataforma AVEPA Elearning. Su resolución aporta 0,15 créditos dentro del sistema de acreditaciones de especialidades veterinarias de AVEPA.
Introducción
Las neoplasias pancreáticas son infrecuentes en gatos, se diagnostican en animales de edad avanzada y en ocasiones suponen un reto diagnóstico. En casos avanzados pueden aparecer efusiones de características estériles. En medicina humana se ha descrito la colonización del líquido efusivo estéril por microorganismos pudiendo desembocar en peritonitis infecciosa. Este proceso no ha sido descrito detalladamente en veterinaria.
El objetivo del presente artículo es la descripción del aislamiento de Pseudomonas aeruginosa en líquido ascítico de un gato con carcinoma pancreático avanzado.
Caso clínico
Se presentó en consulta una gata de 14 años, esterilizada y de vida interior con historia de hiporexia, estreñimiento agudo y distensión abdominal marcada. En la exploración presentó apatía, deshidratación, condición corporal 3/9, atrofia muscular, distensión abdominal marcada con abdomen fluctuante y dolor a la palpación. Además se observó epífora bilateral y secreción nasal purulenta.
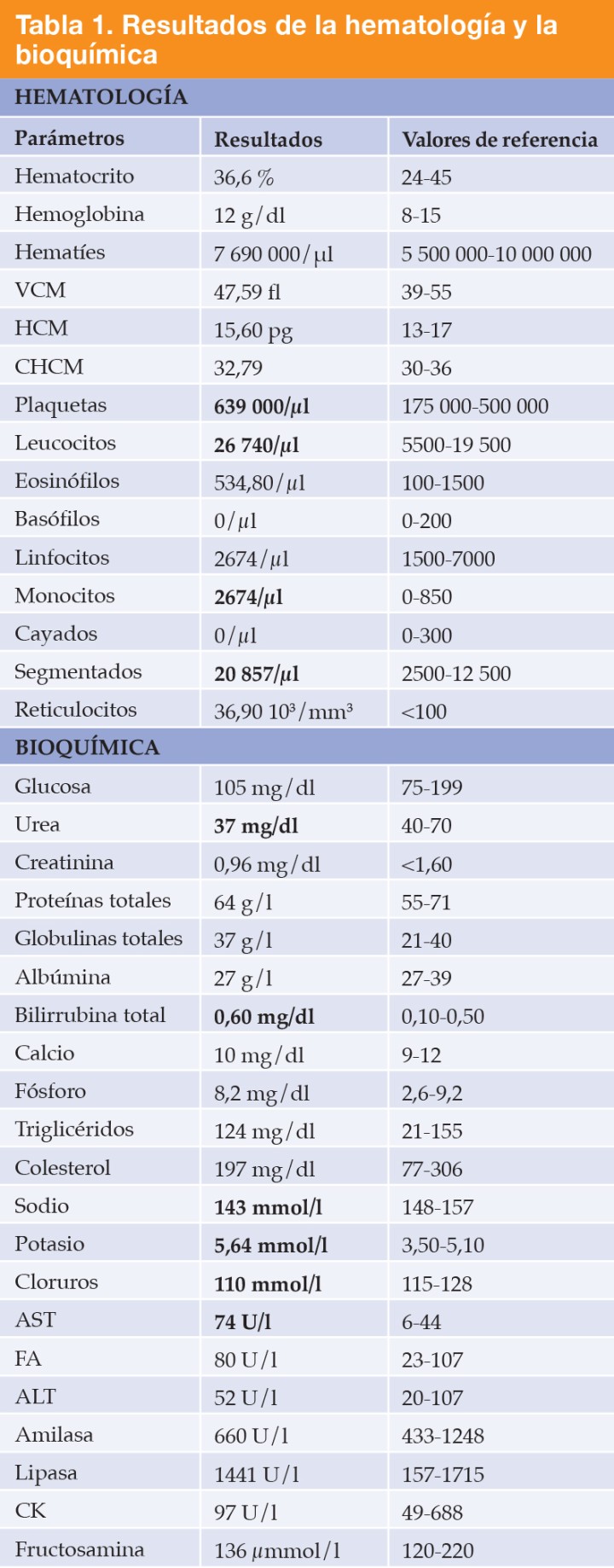
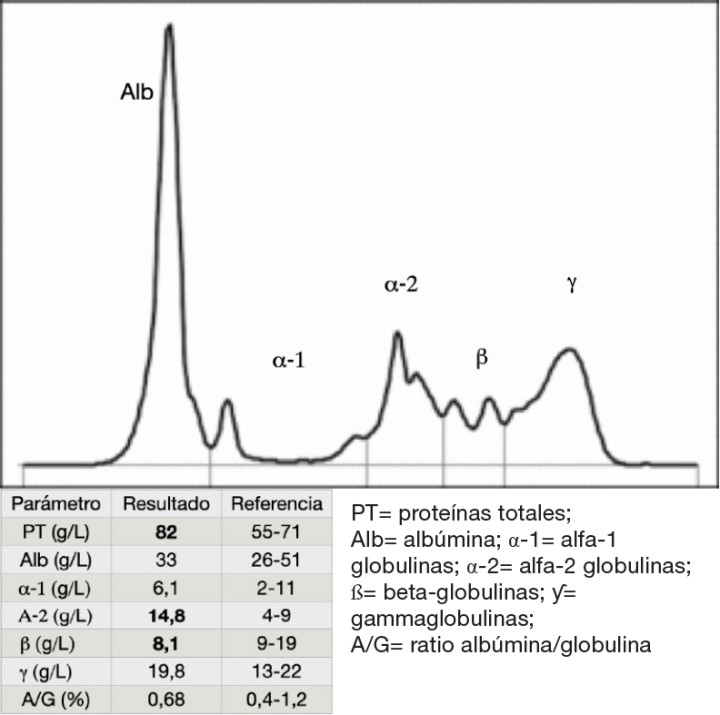
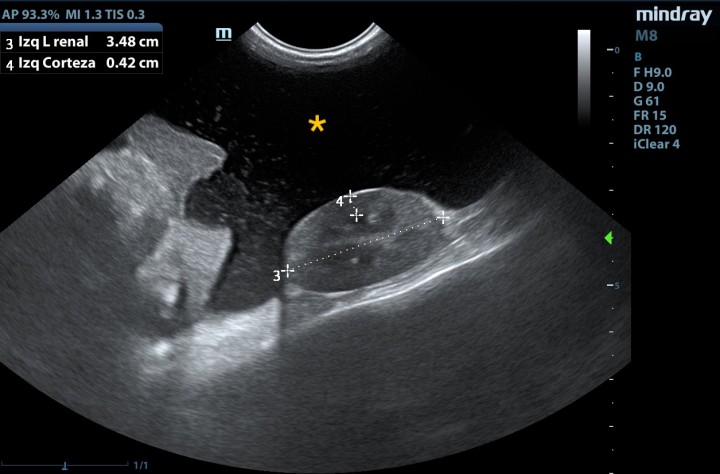
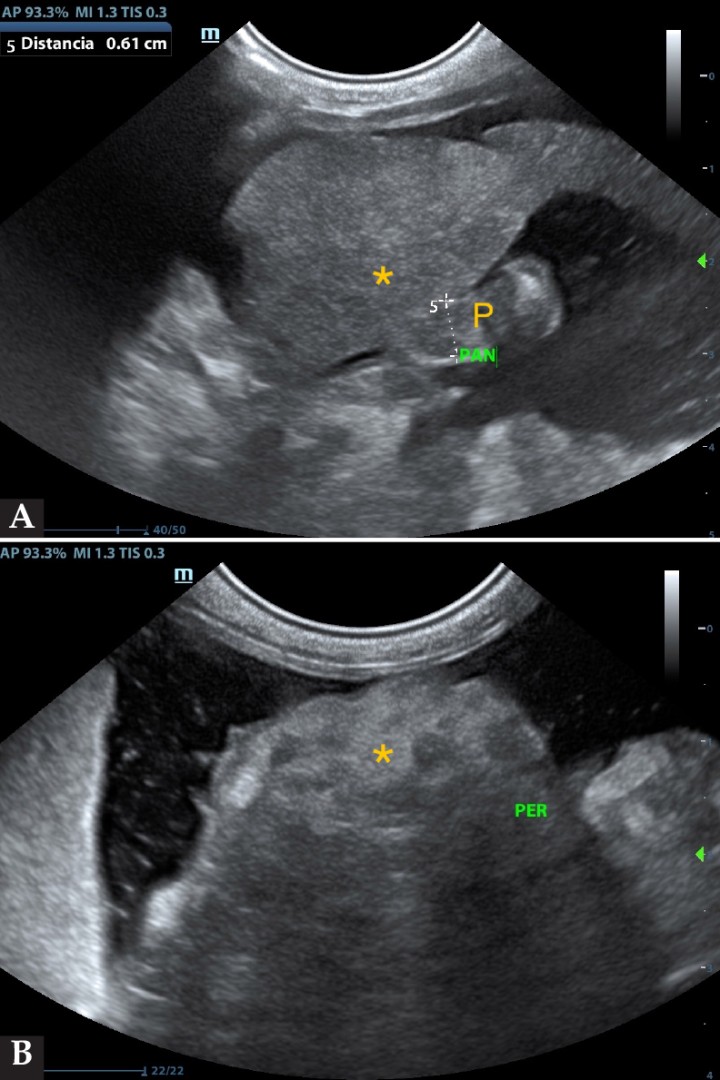
Se realizaron analítica sanguínea, proteinograma sérico y ecografía abdominal. En los resultados (Tabla 1) se observó trombocitosis (plaquetas: 639 x 103/µl, ref: 175-500 x 103/μl) leucocitosis con neutrofilia sin desviación a la izquierda y monocitosis (leucocitos: 26,7 x 103/µl, ref: 5,5-19,5 x 103/μl; neutrófilos: 20,8 x 103/µl, ref: 2,5-12,5 x 103/μl; monocitos: 2,6 x 103/µl, ref: 0-0,850 x 103/μl), hiperbilirrubinemia (bilirrubina: 0,60 mg/dl, ref: 0,1-0,5 mg/dl), hipocloremia (cloro: 110 mmol/l, ref: 115-128 mmol/l), hiponatremia (sodio: 143 mmol/l, ref: 148-157 mmol/l), hiperkalemia (potasio: 5,64 mmol/l, ref: 3,5-5,1 mmol/l), aumento AST (AST: 74 U/l, ref: 6-44 U/l) y disminución de urea (urea: 37 mg/dl, ref: 40-70 mg/dl). En el proteinograma (Fig. 1) se observó un aumento de las proteínas totales (proteínas: 82 g/l, ref: 55-71 g/l) con aumento de las alfa-2 globulinas (alfa-2 globulinas: 14,8 g/l, ref: 4-9 g/l) y disminución de las beta-globulinas (beta-globulinas: 8,1 g/l, ref: 9-19 g/l). Se realizó una ecografía abdominal en la que se observó abundante líquido libre abdominal y la presencia de una masa heterogénea en la zona pancreática, además del incremento de la ecogenicidad y aspecto heterogéneo del peritoneo, lesiones nodulares hepáticas, y efusión pleural escasa (Figs. 2 y 3).
VCM= volumen corpuscular medio; HCM = hemoglobina corpuscular media; CHCM= concentración hemoglobina corpuscular media; AST= aspartato aminotransferasa; FA= fosfatasa alcalina; ALT= alanina aminotransferasa.
Figura 1
Electroforesis de proteínas en suero.
Figura 2
Presencia de líquido libre abdominal (*).
Figura 3
(A) Masa abdominal (*) asociada a la zona pancreática (P). (B) Masa abdominal de grandes dimensiones (*) y líquido libre abdominal.
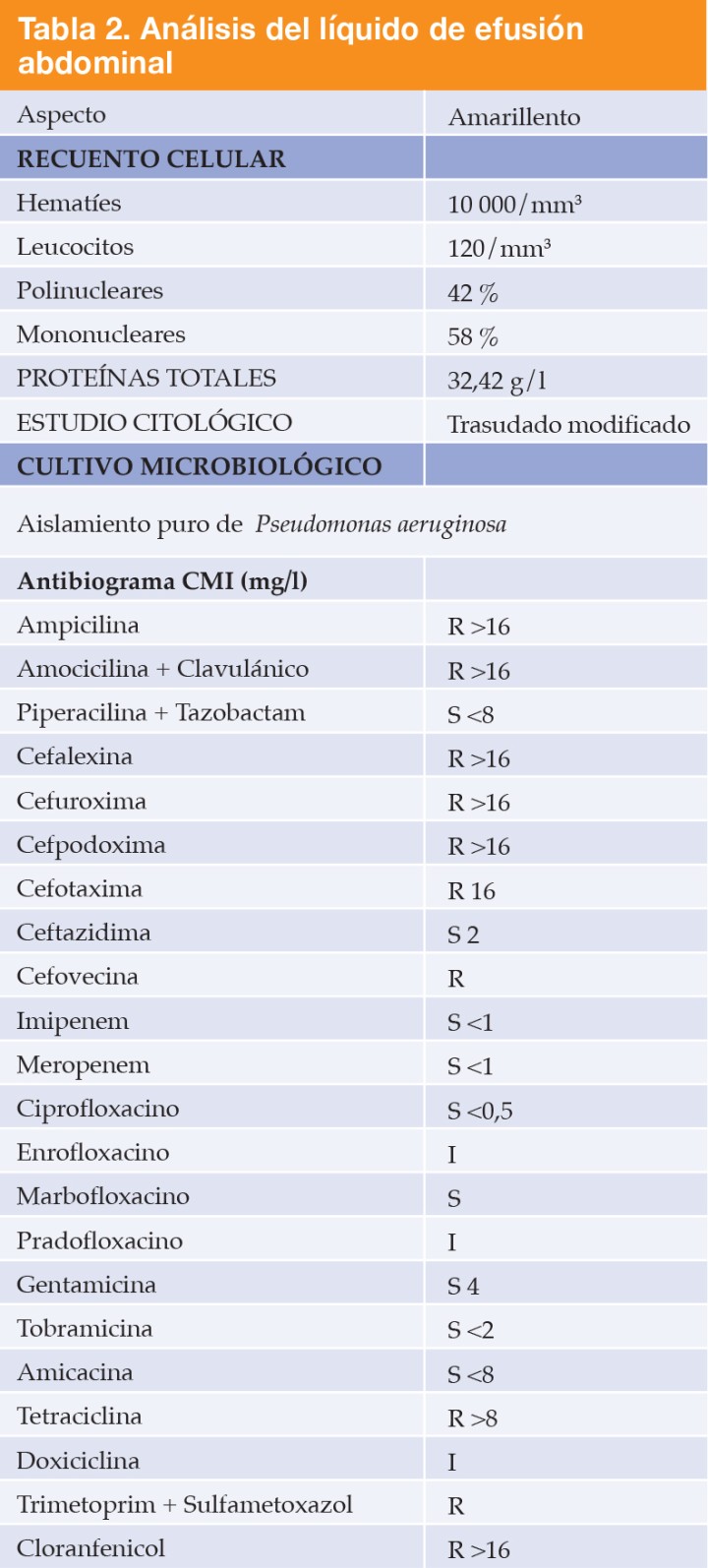
Se realizó una abdominocentesis ecoguiada obteniéndose una muestra de líquido amarillento que se clasificó como trasudado modificado (Tabla 2), con presencia escasa de neutrófilos, linfocitos, histiocitos y algunas células mesoteliales reactivas, sin observarse microorganismos ni evidencia de malignidad. Se remitió una muestra para cultivo microbiológico. Se recomendó la realización de punciones ecoguiadas y citologías para determinar el origen de las lesiones, aunque no pudieron realizarse debido a limitaciones presupuestarias. Por decisión del propietario el animal fue dado de alta, se administró cefovecina a dosis de 8 mg/kg vía subcutánea (Convenia, Zoetis Belgium SA, Bélgica) y se pautó mirtazapina (1,88 mg cada 48 horas por vía oral, Laboratorios Cinfa, Huarte) como estimulante del apetito. El animal se presentó a las 48 h con empeoramiento del estado general y se le practicó la eutanasia humanitaria. El propietario consintió la necropsia.
R= resistente; S=sensible; I=intermedio; CMI= concentración mínima inhibitoriaasa.
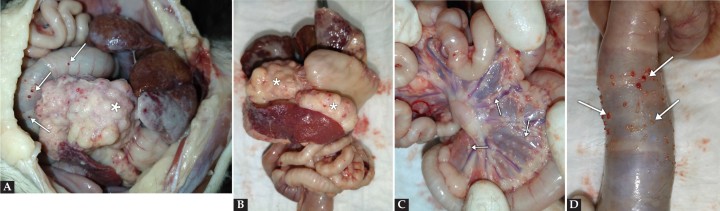
Los hallazgos de la necropsia (Fig. 4) fueron abundante líquido libre abdominal amarillento (500 ml), presencia de múltiples lesiones nodulares en peritoneo, diafragma, mesenterio y serosa intestinal, así como la presencia de una masa irregular de grandes dimensiones correspondiente al páncreas. En la cavidad torácica se observaron áreas consolidadas en parénquima pulmonar y derrame pleural.
Figura 4
(A) Aspecto de la cavidad abdominal durante la necropsia una vez aspirado el líquido efusivo. Se observa una masa de grandes dimensiones (*). (B) Masa abdominal (*) relacionada con órganos abdominales. (C) Carcinomatosis (flechas) en mesenterio. (D) Carcinomatosis (flechas) en serosa de colon. (A, C) Se observan múltiples nódulos (flechas) en serosas correspondientes a metástasis.
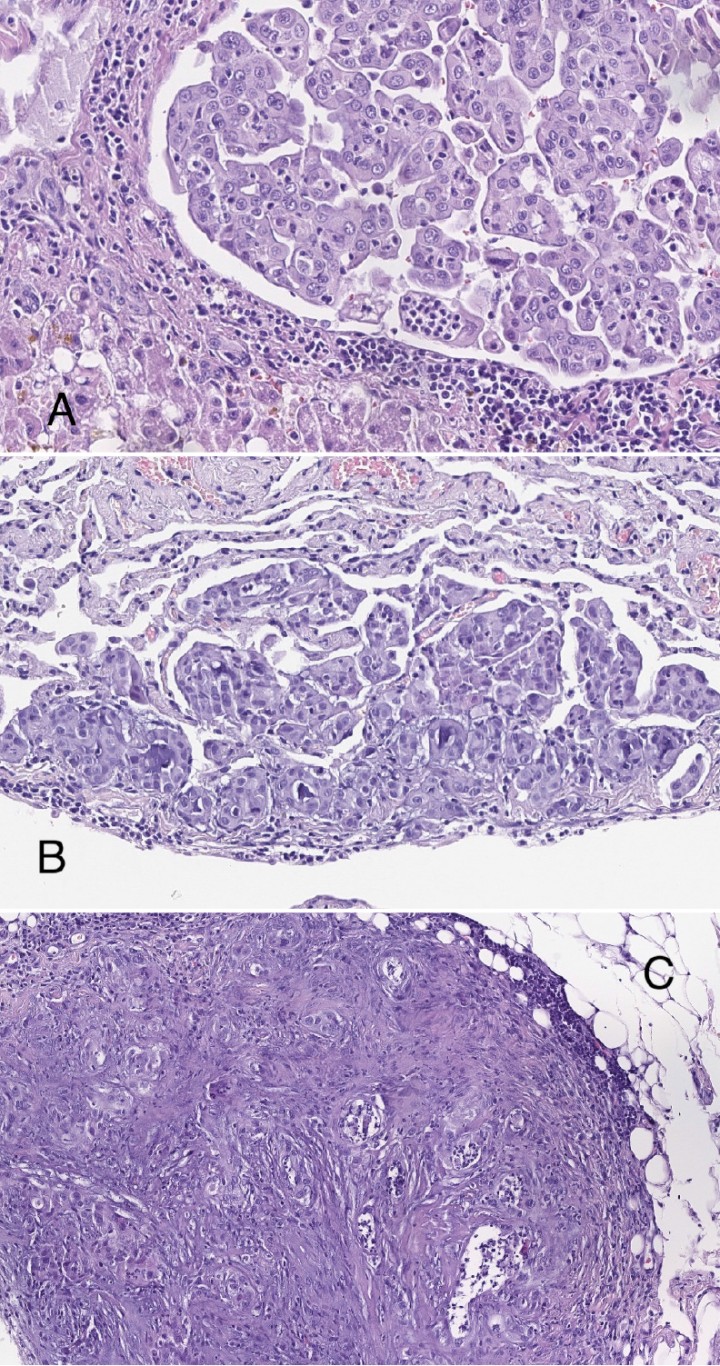
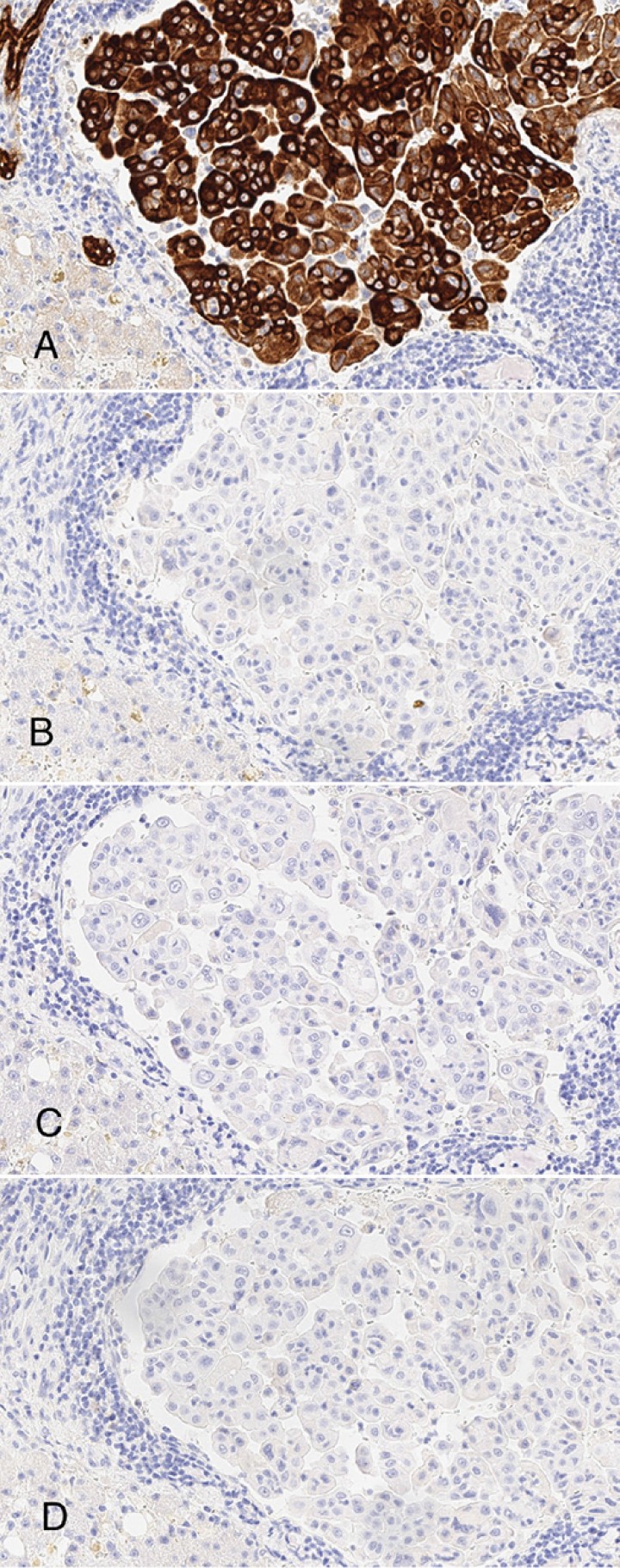
En la histopatología (Fig. 5) se observó una infiltración difusa multifocal afectando a páncreas, pulmón, hígado, diafragma y peritoneo de célula epitelial atípica organizada en nidos irregulares o émbolos intravasculares, caracterizada por un escaso citoplasma eosinófilo, núcleo pleomorfo hipercromático y nucléolo prominente. Se observó la presencia ocasional de formaciones adenoides primitivas, en algunos casos con material mucinoide intraluminal. Los resultados fueron consistentes con metástasis multiorgánica de carcinoma indiferenciado. Se realizó un estudio inmunohistoquímico que resultó positivo para AE1/AE3 y negativo para vimentina, CEA, cromogranina y sinaptofisina (Fig. 6). En base al origen de la masa principal y los resultados inmunohistoquímicos, el diagnóstico histopatológico fue de carcinoma pancreático exocrino.
Figura 5
(A) Imagen de la infiltración de la neoplasia en hígado (x200, tinción H/E). (B) Imagen de la infiltración de la neoplasia en pulmón (x200, tinción H/E). (C) Infiltración de la neoplasia en serosa (x200, tinción H/E).
Figura 6
(A) Células neoplásicas positivas para AE1 AE 2 (x200, tinción inmunohistoquímica para citoqueratinas AE1 AE2). (B) Células neoplásicas negativas para CEA (x200, tinción inmunohistoquímica para CEA). (C) Células neoplásicas negativas para Cromogranina (x200, tinción inmunohistoquímica para Cromogranina). (D) Células neoplásicas negativas para Sinaptofisina (x200, tinción inmunohistoquímica para Sinaptofisina).
El cultivo de líquido ascítico dio como resultado el aislamiento puro de Pseudomonas aeruginosa resistente a la cefovecina (Tabla 2).
Discusión
Las neoplasias del páncreas exocrino son infrecuentes en gatos y aparecen en animales de edad avanzada. Los signos clínicos asociados son inespecíficos, incluyendo anorexia, vómito, dolor abdominal, palpación de una masa abdominal e ictericia, y su patogenia suele ser de corto recorrido (7-30 días). Los resultados laboratoriales son también inespecíficos, incluyendo neutrofilia, aumento de ALT e hiperglicemia.1
La ecografía abdominal realizada en el paciente puso de manifiesto la presencia de abundante líquido abdominal libre, así como de una masa abdominal asociada a la zona pancreática. En gatos, el diagnóstico ecográfico de neoplasias pancreáticas puede ser complejo y en ocasiones difícil de diferenciar de otros procesos pancreáticos, como la hiperplasia, aunque la presencia de una masa mayor a 2 centímetros se ha relacionado con la presencia de neoplasia.2
En el presente caso, se diagnosticó un carcinoma pancreático indiferenciado. Actualmente, no se ha encontrado relación entre la progresión de la enfermedad y la diferenciación histopatológica de la neoplasia.3 En cuanto al comportamiento de la neoplasia, los carcinomas pancreáticos en ocasiones invaden tejidos adyacentes y producen siembra en la cavidad peritoneal como se describe en el presente caso.4 Aunque se considera un indicador de mal pronóstico, la presencia de metástasis en casos de carcinoma pancreático felino no resulta significativa en cuanto a la supervivencia.3
Determinar el origen de un adenocarcinoma metastásico indiferenciado a partir de la histopatología plantea dificultades. En medicina humana se han descrito combinaciones de marcadores para identificar su origen, aunque el patrón inmunohistoquímico pancreático y de ductos biliares son similares (TTF-1 negativo, CDX2 negativo, CK7 positivo, CEA positivo, MUC5AC positivo).5
En este caso se determinó el origen de la neoplasia en base a la identificación macroscópica de una masa pancreática de grandes dimensiones y los resultados histopatológicos fueron compatibles con un tumor de origen epitelial. Las células neoplásicas fueron positivas para los marcadores inmunohistoquímicos de citoqueratinas AE1/AE3 y negativas para vimentina, CEA, cromogranina A y sinaptofisina, pudiéndose diferenciar de una neoplasia de origen neuroendocrino. El uso de estos marcadores ha sido validado en el gato.6
La citología de las lesiones mediante punción con aguja fina es una herramienta útil para orientar el diagnóstico de masas abdominales por ser una técnica poco invasiva y rápida de realizar. Permite, en primer lugar, diferenciar el carácter inflamatorio o neoplásico del tejido examinado y, en caso de neoplasia, permite orientar el tipo y grado de diferenciación tumoral. En el caso actual no fue posible realizar citología por limitaciones de presupuesto.
La aparición de efusión abdominal es común en casos avanzados de carcinomatosis peritoneal y empeora el pronóstico. Se cree que los mecanismos por los que aparece resultan de la combinación de obstrucción linfática y alteración de la permeabilidad vascular.7 La presencia de efusión abdominal se ha relacionado con una menor supervivencia en gatos con carcinoma pancreático.3
El líquido ascítico se clasificó como trasudado modificado causado presumiblemente por la neoplasia. Las características principales fueron baja celularidad, pobre en proteínas y ausencia de patógenos en la citología. El crecimiento bacteriano en el cultivo contrasta con las características aparentemente asépticas del líquido abdominal. En medicina veterinaria, el estudio citológico de fluidos presenta una sensibilidad limitada para la detección de infección, situándose alrededor del 80 % en el caso de efusiones abdominales.8 El cultivo microbiológico sigue siendo la prueba de elección para la detección de infección. En este caso se obtuvo crecimiento bacteriano aunque no se identificaron lesiones sugestivas de infección durante la necropsia.
En medicina humana se describen dos entidades independientes en las que líquidos efusivos de características estériles presentan crecimiento bacteriano en cultivo. La peritonitis bacteriana espontánea (PBE) obedece a la infección de líquido ascítico con recuento de neutrófilos superior a 250 células por microlitro en la citología y cultivo positivo en ausencia de signos de infección. Se describe en pacientes con cirrosis y en menor medida oncológicos,9 asociado a hipertensión portal y translocación bacteriana, aunque se han descrito casos de pacientes oncológicos sin evidencia de hipertensión.10 La bacterioscitis (BA), por otro lado, constituye una entidad independiente y se caracteriza por el crecimiento bacteriano a partir de líquido ascítico de características aparentemente estériles con recuento de neutrófilos menor a 250 células por microlitro y que puede evolucionar a PBE.11 Según el conocimiento de los autores, estos procesos no han sido descritos detalladamente en pequeños animales, aunque existen estudios en los que la peritonitis bacteriana espontánea y la peritonitis bacteriana primaria se han considerado una única entidad.12
Pseudomonas aeruginosa se considera un patógeno oportunista ubicuo, presente en el tracto digestivo. En medicina humana se describen infecciones nosocomiales en pacientes inmunosuprimidos durante procedimientos de diálisis peritoneal, cirrosis o por perforación de vísceras y fenómenos de translocación bacteriana a través de barrera intestinal o vía hematógena causando neumonía o sepsis.13-15 En medicina veterinaria el aislamiento de Pseudomonas ha sido descrito en casos de peritonitis en perros12 y gatos.16
El origen de la colonización del microorganismo fue incierto. La recolección del líquido ascítico fue realizada de manera aséptica, mediante rasurado y desinfección previa, y la abdominocentesis fue ecoguiada utilizando un sistema cerrado, lo que minimiza una posible contaminación. En la necropsia no se evidenciaron indicios de perforación que pudiesen explicar la aparición de la bacteria. La vía hematógena no puede ser descartada, ya que no se cursaron cultivos sanguíneos.
Una posible explicación al aislamiento de P. aeruginosa a partir del líquido efusivo de características a priori estériles sería la colonización del líquido ascítico de origen neoplásico por parte del microorganismo, fenómeno análogo a la BA descrita en humanos que potencialmente podría derivar en PBE.
La vía de entrada de la bacteria, aunque se desconoce, podría explicarse por la presencia de la masa pancreática, ya que se ha descrito la translocación bacteriana como causa de peritonitis séptica en gatos con patología pancreática.16
En este artículo se describe el aislamiento de P. aeruginosa a partir de líquido ascítico de un gato con carcinoma pancreático en fase avanzada de enfermedad con diseminación peritoneal (carcinomatosis). Este hallazgo pone de manifiesto la necesidad de realizar cultivo de fluidos efusivos asociados a neoplasias pancreáticas avanzadas en gatos, aun presentando características aparentemente estériles. Son necesarios estudios adicionales para investigar la posible relación entre la enfermedad neoplásica y el aislamiento de microorganismos, así como los mecanismos de su patogenia.
Fuente de financiación: este trabajo no se ha realizado con fondos comerciales, públicos o del sector privado.
Conflicto de intereses: los autores declaran que no existe conflicto de intereses.
Bibliografía
- 1.
Seaman RL. Exocrine pancreatic neoplasia in the cat: a case series. J Am Anim Hosp Assoc 2004; 40: 238-245.
[PubMed] - 2.
Hecht S, Pennink DG, Keating JH: Imaging findings in pancreatic neoplasia and nodular hyperplasia in 19 cats. Vet Radiol Ultrasound 2007; 48: 45-50.
[PubMed] - 3.
Linderman MJ, Brodsky EM, De Lorimier LP, Clifford CA, Post GS: Feline exocrine pancreatic carcinoma: a retrospective study of 34 cases. Vet Comp Oncol 2012; 11(3): 208-218.
[PubMed] - 4.
Cullen JM: Liver, biliary system, and exocrine pancreas. En Pathologic basis of veterinary disease, St Louis, Elsevier Saunders, 2007; 393-461.
- 5.
Seog-Yun P, Baek-Hee K, Jung-Ho K, Sun L, Gyeong Hoon K. Panels of immunohistochemical markers help determine primary sites of metastatic adenocarcinoma. Arch Pathol Lab Med 2007; 131: 1561-1567.
[PubMed] - 6.
Michishita M, Takagi M, Kishimoto T, et al. Pancreatic neuroendocrine carcinoma with exocrine differentiation in a young cat. J Vet Diagn Invest 2017; 29(3): 325-330.
[PubMed] - 7.
Sangisetty SL, Miner TJ. Malignant ascites: A review of prognostic factors, pathophysiology and therapeutic measures. World J Gastrointest Surg 2012; 4(4): 87-95.
[PubMed] - 8.
Allen BA, Evans S. Diagnostic accuracy of cytology for the detection of bacterial infection in fluid samples from veterinary patients. Vet Clin Pathol 2022; 51(2): 252-257.
[PubMed] - 9.
Makharia GK, Sharma BC, Bhasin DK, Singh KD. Spontaneous bacterial peritonitis in a patient with gastric carcinoma. J Clin Gastroenterol 1998; 27:3 269-270.
[PubMed] - 10.
Mañas MD, Marchán EC, Ceres AF, Gijón JR. Peritonitis bacteriana espontánea como forma de debut de adenocarcinoma de colon. Anal Medic Int 2005; 22:5 251-252.
[PubMed] - 11.
Oey RC, Van Buuren HR, De Jong DM, Erler NS, De Man RA. Bacterascites: A study of clinical features, microbiological findings, and clinical significance. Liver Int 2018; 38: 2199-2209.
[PubMed] - 12.
Culp WT, Zeldis TE, Reese MS, Drobatz KJ: Primary bacterial peritonitits in dogs and cats: 24 cases (1990-2006). J Am Vet Med Assoc 2009; 234: 906-913.
[PubMed] - 13.
Markou P, Apidianakis Y. Pathogenesis of intestinal Pseudomonas aeruginosa infection in patients with cancer. Front Cell Infect Mi 2014; 3: 115.
[PubMed] - 14.
Chatzinikolaou I, Abi-Said D, Bodey GP, et al. Recent experience with Pseudomonas aeruginosa bacteremia in patients with cancer. Arch Intern Med 2000; 160: 501-509.
[PubMed] - 15.
Marciano S, Díaz JM, Dirchwolf M, Gadano A. Spontaneous bacterial peritonitis in patients with cirrhosis: incidence, outcomes, and treatment strategies. Hepat Med 2019; 11: 13-22.
[PubMed] - 16.
Costello MF, Drobatz KJ, Aronson LR, King LG: Underlaying cause, pathophysiologic abnormalities, and response to treatment in cats with septic peritonitis: 51 cases (1990-2001). J Am Vet Med Assoc 2004; 225: 897-902.
[PubMed]