Utilización de células mesenquimales estromales adiposas para el tratamiento coadyuvante de la gingivoestomatitis crónica felina en un caso clínico refractario
Use of adipose mesenchymal stromal cells for the adjuvant treatment of feline chronic gingivostomatitis in a refractory clinical case
M. Cifuentes-Gómez, M. Portugués-Aróstegui, J. Benito-de la Víbora, D. García-Bernal, P. García-Fernández, J.I. Gil-Chinchilla
Contacto: jigchinchilla@gmail.com
Resumen
Se presenta una gata común Europea de 4 años, 3,7 kg de peso, ovariohisterectomizada, diagnosticada de gingivoestomatitis crónica felina (GECF) en 2020, que resultó ser refractaria a tratamientos médico-quirúrgicos convencionales. Se inició un tratamiento coadyuvante a interferón-omega, ciclosporina y dieta hipoalergénica con terapia celular basada en células estromales mesenquimales adiposas (AT-MSC). Para la obtención de estas células se realizó una extracción quirúrgica de tejido adiposo subcutáneo. Este fue procesado y las AT-MSC fueron aisladas, cultivadas y expandidas (hasta el 4º subcultivo). Una vez finalizado este proceso, las células se administraron a la paciente de forma intravenosa e intralesional. Se controló su evolución mediante el sistema de puntuación SDAI (Stomatitis Disease Activity Index) durante 16 meses. Un mes después de administrar las AT-MSC, se produjo una disminución muy significativa de la puntuación SDAI, con una disminución de la inflamación en la mucosa oral y un aumento de apetito, nivel de actividad y acicalamiento. Al año de la primera dosis se administró una segunda. Actualmente la gata continúa bajo supervisión veterinaria y se mantiene estable. El uso de AT-MSC podría representar una alternativa terapéutica en casos refractarios de GECF. Su administración intravenosa e intraoral resultó ser segura y eficaz como tratamiento coadyuvante a los tratamientos convencionales en el caso clínico expuesto, obteniendo una evolución muy favorable y una mejoría sustancial de su calidad de vida.
Palabras clave: gingivoestomatitis crónica felina, tratamiento, terapia celular, células estromales mesenquimales, AT-MSC.
Clin Vet Peq Anim 2023, 43 (2): 91-99
Summary
We present a 4-year-old, 3.7 kg of weight, ovariohysterectomized, common European female cat diagnosed with feline chronic gingivostomatitis (FCGS) in 2020, which proved to be refractory to conventional medical-surgical treatments. Cell therapy based on autologous adipose-derived mesenchymal stromal cells (AT-MSC) was started as an adjuvant treatment to interferon-omega, cyclosporine, and a hypoallergenic diet. To obtain these cells, a surgical extraction of subcutaneous adipose tissue was performed. This was processed, and the AT-MSCs were isolated, cultured, and expanded (up to the 4th subculture). Once this process was completed, the cells were intravenously and intralesionally administered to the patient. Her evolution was monitored using the SDAI (Stomatitis Disease Activity Index) scoring system for 16 months. One month after the administration of AT-MSC, there was a very significant decrease in the SDAI score, with a decrease in oral mucosal inflammation and an increase in appetite, activity level, and grooming. A second cell dose was administered one year after the first. Currently, the cat continues under veterinary supervision and remains stable. The use of AT-MSC could represent a therapeutic alternative in refractory cases of FCGS. Its intravenous and intraoral administration has proved to be safe and effective as an adjuvant treatment to conventional treatments in the clinical case exposed, obtaining a very favourable result and a substantial improvement in her quality of life.
Keywords: feline chronic gingivostomatitis, treatment, cell therapy, mesenchymal stromal cells, AT-MSC.
Clin Vet Peq Anim 2023, 43 (2): 91-99

La presencia de este logo en un artículo de la revista indica que se publicará un examen sobre el mismo en la plataforma AVEPA Elearning. Su resolución aporta 0,15 créditos dentro del sistema de acreditaciones de especialidades veterinarias de AVEPA.
Introducción
La gingivoestomatitis crónica felina (GECF) es una enfermedad inflamatoria e inmunomediada de la boca de los gatos, que se presenta generalmente con lesiones inflamatorias bilaterales crónicas, ulcerativas y/o proliferativas, que inicialmente afectan a las encías y/o mucosas de la cavidad oral (alveolar, labiobucal y oral caudal), pudiendo extenderse a otras zonas como la lengua, la faringe y el paladar.1,2 La GECF se caracteriza fundamentalmente por la presencia de estomatitis caudal, lateral a los pliegues palatoglosos o fauces, y por la presencia de una periodontitis severa generalizada con mayor prevalencia de reabsorciones radiculares y raíces retenidas que la distingue de otras enfermedades orales felinas.3,4 Los animales que padecen esta enfermedad presentan signos clínicos como anorexia, halitosis (mal aliento), sialorrea (babeo), reducción del acicalamiento, pérdida de piezas dentales y de peso, dolor bucal intenso, etc.1,3 A esta sintomatología, hay que añadir también la presencia de esofagitis descrita en el 98 % de los casos de GECF investigados, y con afectación principalmente del tercio proximal del esófago (75,9 %) en un estudio desarrollado por Kouki MI y colaboradores.4 La prevalencia de esta enfermedad ha sido descrita entre un 0,7-12 %.5-7 Sin embargo, en otro estudio sobre gatos callejeros y GECF realizado en Corea del Sur, se informó que su prevalencia para esta población podría ser mayor, en torno al 27 %.2 Estas variaciones en la prevalencia pueden ser influenciadas por factores de riesgo, como la presencia de lesiones ulcerativas en la lengua, agentes infecciosos concomitantes y/o la cohabitación de más de un gato en un mismo sitio (colonias y hogares multigato), que aumentan las probabilidades de padecer GECF.2,3,8
La etiopatogenia de esta enfermedad es compleja y multifactorial, y se cree que el sistema inmune juega un papel fundamental,1,4 observándose un aumento de los linfocitos CD8+ (citotóxicos) con respecto a los CD4+ (colaboradores), tanto a nivel local como sistémico, lo que se traduce en una disminución de la ratio de linfocitos T CD4+/CD8+.5,9
Por tanto, su etiología vendría derivada principalmente del importante factor inmunopatológico, que se produce como consecuencia de la respuesta inmune exacerbada que se daría en la mucosa oral por una estimulación antigénica crónica producida por diversos factores infecciosos y/o inmunomediados que pueden interactuar por separado o sinérgicamente produciendo la enfermedad.1,7,10 Entre estos factores, la GECF se ha relacionado con diversos patógenos infecciosos como el calicivirus (FCV), el virus de la leucemia felina (FeLV), el virus de la inmunodeficiencia felina (FIV), el herpesvirus felino de tipo 1 (FHV-1), Bartonella spp. o el Virus Espumoso Felino (FFV), entre otras.1,7,11 Sin embargo, a pesar de los indicios de una posible relación entre la GECF y el FCV u otros agentes infecciosos, los resultados de muchas investigaciones son contradictorios y su papel en la GECF sigue siendo desconocido. Por otro lado, también se han identificado otros factores que podrían contribuir al desarrollo de la GECF como la presencia de enfermedades dentales (reabsorciones y periodontitis), reacciones de hipersensibilidad a la placa bacteriana y/o alergias alimentarias.1,5,7,10
Actualmente, las terapias recomendadas consisten en tratamientos quirúrgicos, médicos y/o paliativos del dolor, pero ninguna de ellas ha logrado una tasa de éxito del 100 %.7 Todas las propuestas de tratamiento convencional producen únicamente una mejoría parcial y temporal, pero si se combinan entre sí, las tasas de curación suelen ser mayores.
En general, existen dos enfoques para el tratamiento de la GECF: quirúrgico y médico.10 Sin embargo, por sí solo, el tratamiento médico no suele tener resultados favorables a largo plazo, por lo que el tratamiento estándar actual consiste en la realización de exodoncias o extracciones dentales con o sin tratamiento médico adicional, sugiriéndose una amplia gama de combinaciones terapéuticas (analgésicos, antibióticos, corticoesteroides, inmunomoduladores, dietas, etc.)3,5-7,10 obteniéndose 3 tipos de respuestas al tratamiento: 1) remisión completa, 2) mejoría significativa y 3) poca o ninguna mejoría.
Las exodoncias pueden ser selectivas (sobre las piezas afectadas), parciales (incluyendo premolares y molares) y totales (extrayendo todos los dientes, incluidos los colmillos). Algunos estudios1,10,12 han demostrado que las extracciones parciales o totales proporcionan mejores resultados a largo plazo, con tasas de mejoría completa o sustancial. Sin embargo, parece que la extensión de estas extracciones tiene poco efecto sobre el resultado final, por lo que la principal recomendación como primera fase del tratamiento de la GECF es la realización de una extracción parcial, incluyéndose además los dientes afectados por otros motivos independientes como periodontitis severa, lesiones resortivas y/o restos radiculares, ya que en el 67-80 % de los casos se obtiene una remisión completa de las lesiones de la GECF o una mejora clínica sustancial.7,10,13,14 Posteriormente, en una segunda fase tras 1-4 meses post-extracción parcial, se puede complementar el tratamiento mediante una exodoncia total si no existe respuesta favorable.3
No obstante, los mismos estudios1,3,6,7,10,12,13 señalan que el 20-30 % restante de los casos muestra poca o nula mejoría tras el tratamiento quirúrgico, presentando recidivas con persistencia de la inflamación oral, siendo necesaria la administración concomitante de tratamientos médicos crónicos o de por vida, presumiblemente por la presencia de otros factores etiológicos, descritos previamente, que agravan el cuadro clínico y provocan variaciones en la respuesta a los tratamientos administrados. Para algunos autores,6,7,13 este 20-30 % de los casos con leves respuestas al tratamiento o nulas serían los considerados como refractarios al tratamiento. Sin embargo, para otros los verdaderamente refractarios serían únicamente los que no mejoran nada tras 1 mes de la exodoncia (6-7 %).1,10,12
Independientemente, en estos casos refractarios donde el tratamiento de elección fracasa y la única opción empieza a ser la eutanasia,7 es necesaria la búsqueda de nuevas alternativas terapéuticas que pudieran proporcionar alguna mejora, como la administración oral de interferón omega y/o ciclosporina,3 o las novedosas y prometedoras terapias celulares basadas en la administración intravenosa de células estromales mesenquimales adiposas (AT-MSC)9,13,15,16 capaces de modular el sistema inmune produciendo una disminución de los linfocitos citotóxicos circulantes y de neutrófilos y citoquinas proinflamatorias, así como un aumento temporal de citoquinas antiinflamatorias y la normalización de la ratio CD4+/CD8+,7,13 no recomendándose actualmente su uso en pacientes sin exodoncia completa por falta de evidencia y eficacia clínica.16
El objetivo de este trabajo es presentar un caso clínico de GECF refractario al tratamiento médico-quirúrgico convencional, que al someterse a la terapia coadyuvante con AT-MSC respondió de forma notablemente positiva. Nuestra hipótesis de partida consistió en que la administración de AT-MSC de manera coadyuvante a los tratamientos convencionales como terapia contra la GECF podría ayudar a mejorar la calidad de vida de nuestra paciente.
Material y métodos
Se presenta una gata común Europea de 4 años, 3,7 kg, ovariohisterectomizada, negativa a FIV y FeLV, pero positiva a FCV mediante PCR de la mucosa oral, diagnosticada de GECF en enero de 2020 y que resultó ser refractaria a tratamientos médico-quirúrgicos convencionales, por lo que se propuso iniciar una terapia celular coadyuvante basada en AT-MSC con la esperanza de mejorar su calidad de vida.
El tratamiento inicial en el momento del diagnóstico de GECF, 18 meses antes de llegar a nuestra consulta de especialidad felina, consistió en un tratamiento odontológico quirúrgico, realizándose inicialmente una exodoncia parcial (extracción de dientes premolares y molares) y posteriormente una total (extracción de todas las piezas dentarias restantes, incluyendo los colmillos). Además, durante esos primeros meses, también se administró tratamiento médico basado en ciclosporina e interferón-omega felino, corticoesteroides (Deflazacort® y Depomoderín®), antiinflamatorios (meloxicam), ciclos de antibióticos (doxiciclina, azitromicina y cefovecina) y otros analgésicos (buprenorfina y gabapentina).
Después de la valoración inicial de la historia clínica y los tratamientos recibidos previamente, se realizó un nuevo examen físico y se propuso a la propietaria administrar AT-MSC como terapia coadyuvante al tratamiento médico actual con interferón-omega, ciclosporina y dieta hipoalergénica.
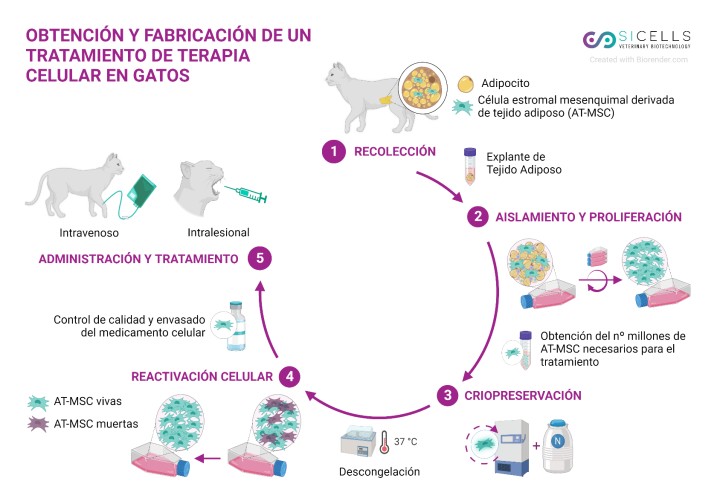
Para la obtención de estas células fue necesario un proceso quirúrgico menor en el que asépticamente se obtuvo una muestra de tejido adiposo de la propia gata. Los explantes de grasa se trasladaron a un laboratorio especializado en terapias celulares veterinarias (SICELLS-Veterinary Biotechnology, Murcia) para su procesamiento en condiciones controladas. Una vez obtenidas las AT-MSC, estas se cultivaron en incubadores (8,5 % CO2 y 95 % de humedad relativa) y tras alcanzarse el 80-90 % de confluencia se sometieron a un proceso de subcultivo, repitiéndose este proceso hasta alcanzar el pase 3, realizando los controles de calidad y viabilidad necesarios y siendo criopreservadas hasta su utilización. Llegado el momento de la administración, las AT-MSC fueron descongeladas y reactivadas en pase 4, transfundiéndose a la paciente una única dosis de 18 millones de AT-MSC, administradas tanto por vía intravenosa (8 millones, aproximadamente 2 millones/kg), como intralesional intraoral (10 millones, inoculadas y distribuidas en las zonas más afectadas) (Fig. 1).
Figura 1
Fases del proceso de obtención y fabricación de un tratamiento con AT-MSC felinas. Creada con Biorender.com
A partir del tratamiento se realizó un seguimiento durante 16 meses a través del sistema de puntuación SDAI (Stomatitis Disease Activity Index).1 De esta forma se estableció una relación entre la terapia celular y la evolución clínica, valorando el manejo de medicación y la respuesta de la paciente.
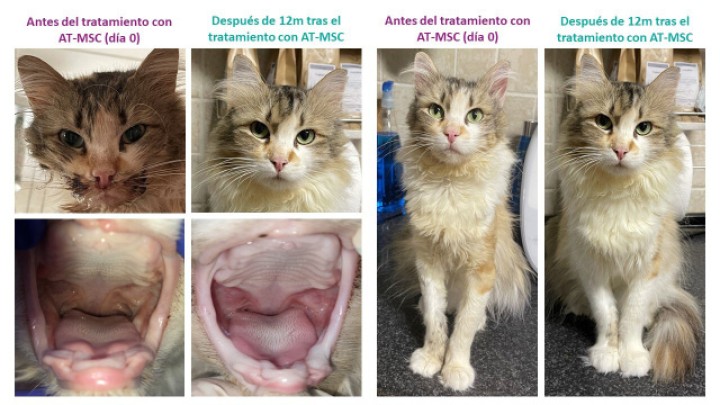
Al mes de administrar la suspensión celular, se produjo una disminución significativa de la puntuación SDAI, debido principalmente a una disminución de la inflamación en la mucosa oral, a una mejora en el apetito y del nivel de actividad y a un aumento del acicalamiento y el confort de la paciente (Fig. 2). Durante el primer año, tras la primera dosis celular de AT-MSC se pautaron revisiones mensuales hasta los 5 meses y posteriormente cada 3-4 meses, volviendo a las revisiones mensuales tras la segunda dosis celular de AT-MSC. Como se puede apreciar en la Fig. 3, a lo largo de las diferentes revisiones esta puntuación SDAI se mantuvo estable, oscilando levemente debido a la modificación (disminución de dosis o eliminación) de la medicación ya instaurada. A los 12 meses de la primera administración de AT-MSC, se decidió administrar una segunda dosis celular, debido a un ligero empeoramiento de los síntomas clínicos, siendo esta vez únicamente coadyuvante a dieta hipoalergénica. La gata continúa aún bajo supervisión veterinaria, habiendo experimentado una mejoría en la sintomatología tras esta segunda administración celular. Sin embargo, a los 3 meses de esta segunda administración de AT-MSC, fue necesaria una dosis de rescate puntual con prednisolona, a la que respondió adecuadamente (Fig. 3), que fue reduciéndose progresivamente.
Figura 2
Fotografías del aspecto físico con detalle de la cavidad oral antes del tratamiento y tras 12 meses de seguimiento tras la administración de la primera dosis de AT-MSC, en las que se observa una mejoría evidente de la paciente.
Figura 3
Gráfica de evolución de la puntuación total SDAI durante el seguimiento de la paciente. SDAI: Stomatitis Disease Activity Index; d: días; m: meses; AT-MSC: células mesenquimales estromales adiposas; mg; miligramos; kg: kilogramos.
Discusión
A pesar de los avances realizados todavía no se ha descubierto un tratamiento 100 % efectivo para el tratamiento de la GECF, donde actualmente la recomendación terapéutica inicial consiste en la realización de una exodoncia parcial de premolares, molares y de otros dientes que pudieran estar afectados, obteniéndose la remisión completa o una mejoría sustancial en el 67-80 % de los casos;10 en el resto de casos sin respuesta favorable a este tratamiento quirúrgico se recomienda proseguir con una exodoncia completa tras 4 meses de la extracción parcial e incluso la adición de tratamiento médico inmunosupresor y/o para el control del dolor (corticoesteroides, ciclosporina, etc.).7,10,13,14
Sin embargo, estos tratamientos presentan una alta tasa de variabilidad individual debido a que la etiología de esta enfermedad sigue siendo poco conocida y con un claro componente multifactorial subyacente que condiciona la respuesta inmune inapropiada que desarrolla cada individuo.10 Por tanto, la identificación de qué factores asociados están contribuyendo al desarrollo de la GECF resulta fundamental para tratar de predecir el éxito del tratamiento quirúrgico y la necesidad de incorporar o no el tratamiento médico. De esta manera, aquellos casos de GECF relacionados con enfermedades dentales (reabsorciones, periodontitis y/o presencia de restos radiculares) responderán mejor al tratamiento quirúrgico, mientras que otros más relacionados con reacciones de hipersensibilidad y alergias alimentarias, o con patógenos infecciosos sistémicos1,5,7,10,11 que producen inmunosupresión generalizada ya sean víricos (FCV, FIV, FeLV o más recientemente también relacionado con coinfecciones con coronavirus felinos,17 o el virus espumoso felino18), bacterianos (Bartonella spp., entre otras) o incluso parasitarios (leishmaniosis, descrito recientemente en un caso clínico19), no responderán tan bien a las exodoncias o lo harán de manera menos eficaz siendo necesaria la adición de tratamientos médicos complementarios; es decir, la presencia o ausencia de estos factores concomitantes condiciona la respuesta terapéutica, la evolución y la calidad de vida de estos gatos.
Según un estudio de Druet I et al. de 2017,3 que evaluaba el efecto beneficioso de las extracciones dentales, se puso de manifiesto que la opinión o el grado de satisfacción del propietario o tutor es complementaria y relevante en el seguimiento de los casos de GECF, a pesar de su subjetividad, ya que se estableció una correlación estadísticamente significativa entre la mejoría clínica observada por parte del veterinario (52 %) y el grado de satisfacción mostrado por el propietario (61 %). El grado de satisfacción era evaluado a través de encuestas o cuestionarios que realizaban los propietarios donde se evaluaba el bienestar y la calidad de vida de estos gatos mediante escalas validadas, a través de parámetros como el grado de acicalamiento, la capacidad para comer alimentos húmedos o secos y/o la presencia de signos de dolor.3
En nuestro caso clínico, la paciente con GECF era negativa a FIV y FeLV, pero positiva a FCV, siendo este un factor asociado a una reducción de la efectividad de los tratamientos médico-quirúrgicos como se ha descrito previamente. Además, utilizamos la escala SDAI porque contempla la posibilidad de combinar puntuaciones a partir de las observaciones del propietario y de las evaluaciones del veterinario en las lesiones clínicas orales, permitiendo evaluar la gravedad de los síntomas clínicos asociados a la GECF. Esta escala ha sido utilizada como herramienta de evaluación y seguimiento del tratamiento con AT-MSC en casos de GECF en numerosos estudios,16,20 siendo recomendada por especialistas veterinarios, tanto de odontología, como de medicina interna o felina. Otra escala sugerida en estos casos es la escala ASIS para la evaluación de la estomatitis caudal, pero no incluye la participación del propietario.3 Sin embargo, ambas escalas (SDAI y ASIS) se centran mucho en la inflamación y en el caso de la SDAI también en la calidad de vida del gato, pero no entran a valorar en detalle otros aspectos directamente relacionados como el dolor. Existen otras escalas diseñadas específica y únicamente para la evaluación del dolor como son la Escala de medición compuesta Felina de Glasgow (CMPS-F), la escala facial felina (Feline Grimace Scale) o la escala de UNESP-Botucatu que pueden ser utilizadas tanto por el veterinario como por el propietario para el seguimiento de pacientes con GECF, aunque no contemplan aspectos específicos de esta enfermedad, ni de la calidad de vida del animal, ni de su peso. Por esta razón, algunos estudios que evaluaban los tratamientos analgésicos en pacientes con GECF21 han utilizado escalas modificadas de las escalas validadas para el dolor agudo felino, como la escala UNESP-Botucatu, para valorar el dolor en la cavidad oral asociado a estos pacientes. No obstante, la recomendación general es que en casos de GECF su utilización sea complementaria a la escala SDAI, pero no exclusiva.
Por otro lado, en el momento de la administración de las AT-MSC, el tratamiento coadyuvante que estaba recibiendo la paciente consistía únicamente en dieta hipoalergénica, interferón omega felino y la ciclosporina. Ambos tratamientos (celular y médico) convivieron durante 1 mes, pero tras observar la mejoría clínica obtenida (con disminución de la inflamación, aumento del apetito, del nivel de actividad, del acicalamiento y confort de la paciente) tras un mes de seguimiento, que se evidenciaba además en las puntuaciones del cuestionario de seguimiento SDAI, se decidió empezar a reducir progresivamente la ciclosporina y el interferón omega felino hasta su completa eliminación, en menos de un mes. La dieta hipoalergénica se mantuvo por decisión veterinaria, por dos razones. Por un lado, no interfiere con el efecto terapéutico de las AT-MSC, al no actuar directamente sobre el sistema inmune, y por otro lado, cuando se intentó un cambio de dieta previamente al tratamiento celular, se produjo una recaída. Además, como se ha comentado anteriormente, la hipersensibilidad o las alergias alimentarias han sido determinadas por diversos autores1,5,7,10 como factores que podrían contribuir al desarrollo de la GECF, por lo que el mantenimiento de una dieta hipoalergénica puede tener sentido como parte del tratamiento como sugieren los estudios publicados por Corbee et al. en 201222 y, posteriormente, en la revisión sistemática de Winer et al. de 2016,10 donde observaron una mejoría en gatos sometidos a exodoncias con mantenimiento de dietas hipoalergénicas ricas en ácidos omega-3 y omega-6.
En relación a los tratamientos regenerativos con AT-MSC para casos de GECF, pueden hallarse en la bibliografía científica reciente como una alternativa coadyuvante a los tratamientos médico-dietéticos ya existentes,23-25 especialmente en casos refractarios, donde algunos autores15,16 han observado mejorías sustanciales o remisiones completas antes de los 12 meses postratamiento en un 70-72 % de los gatos con GECF tratados con AT-MSC. A pesar de los resultados prometedores que parecen observarse en los casos de GECF tratados con estos tratamientos celulares, parece ser que algunos factores individuales como los tratamientos recibidos (previa o conjuntamente), la presencia de enfermedades concomitantes (factores asociados descritos anteriormente), y/o el momento de la aplicación de la terapia celular (antes o después de la exodoncia) pueden afectar la respuesta final obtenida con las AT-MSC en estos pacientes.1,5,6,8-10,15,16,20-25
Aun así, estos estudios remarcan la necesidad de continuar con esta línea de investigación para determinar las condiciones ideales para obtener los mejores resultados. Algunos de los puntos que necesitan clarificación y más evidencia científica son los concernientes al uso de las AT-MSC frescas o criopreservadas, alogénicas o autólogas, dosis celular y pauta de repetición del tratamiento, así como su vía de administración (intravenosa, intralesional o local y/o combinaciones de ellas u otras), etc.20,26
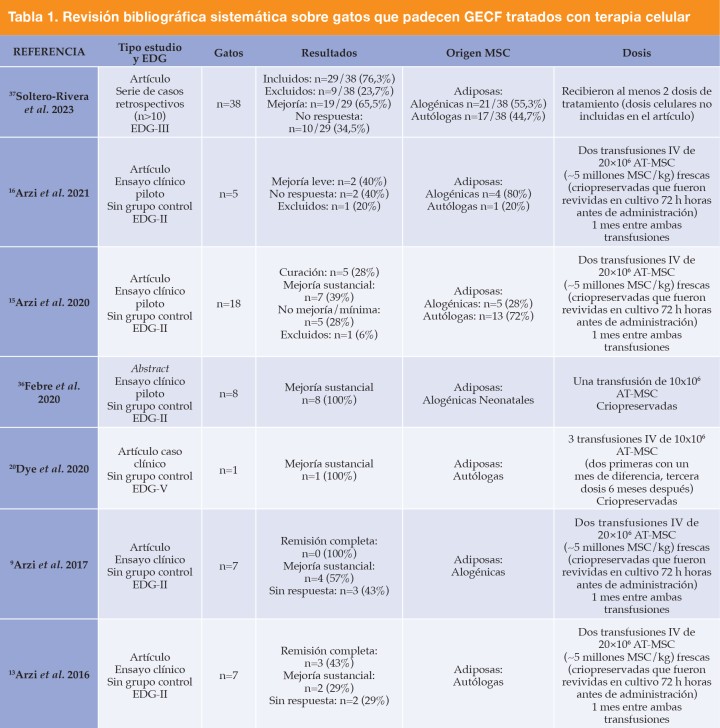
La evidencia científica actual ha sugerido también la administración por vía intraarterial de este tipo de terapias celulares. No obstante, esta vía de administración es controvertida debido a la alta capacidad agregante que tienen las AT-MSC, implicando un mayor riesgo de trombosis. Sin embargo, hay muy pocos estudios en los que se utilice esta vía de administración en medicina veterinaria y con resultados en ocasiones contradictorios o poco concluyentes.27-30 En relación a la GECF y estas nuevas terapias celulares, los autores de este caso clínico han realizado una breve revisión sistemática (Tabla 1) y, en su conocimiento, aún no se ha utilizado esta vía de administración por vía intraarterial en el tratamiento de GECF.
n: tamaño muestral; h: horas; MSC: células mesenquimales estromales; EDG: Experimental design grade, sistema de categorización de la calidad del diseño experimental; IV: vía intravenosa.
Independientemente de su vía de administración, su mecanismo de acción se basa en sus propiedades inmunomoduladoras e inmunosupresoras a través de las cuales son capaces de inhibir la proliferación y activación de diferentes células del sistema inmune.7,13,26
A priori, la terapia con AT-MSC no presenta efectos adversos relevantes, ya que estas células son consideradas inmunoevasivas al no expresar el complejo mayor de histocompatibilidad tipo II (MHC-II), evitándose de esta manera la estimulación de la respuesta adaptativa del sistema inmune.26,31,32 Sin embargo, sí expresan, aunque en muy bajos niveles el complejo mayor de histocompatibilidad de tipo 1 (MHC-I), por lo que si las células proceden de un donante de la misma especie (trasplante alogénico) o de otra especie (trasplante xenogénico) podría producirse la interacción entre estas células y el sistema inmune del huésped, dando lugar a determinadas respuestas, en algunos casos adversas, como la activación del sistema del complemento y la cascada de coagulación.33 Sin embargo, estos efectos adversos pueden en gran parte reducirse al utilizar células autólogas procedentes del propio paciente.34 Otros estudios como los de Arzi B et al. de 202015 han descrito efectos adversos como hinchazón, edema cutáneo e incluso necrosis en las extremidades donde se habían realizado las administraciones intravenosas del tratamiento celular. También, asociado a esta vía de administración, se han descrito otros signos clínicos respiratorios (con aumento de la frecuencia respiratoria), gastrointestinales (vómitos y diarreas o estreñimiento) y febriles que fueron transitorios y se resolvieron espontáneamente en pocas horas, no observándose otros efectos secundarios adversos ni complicaciones mortales. Esta sintomatología puede deberse a factores relacionados con las propias AT-MSC, como su capacidad agregante pudiendo dar lugar a la formación de trombos celulares, así como a la cantidad de células administradas y el ritmo de infusión en la administración, lo que unido a su capacidad procoagulante puede producir extravasaciones de los catéteres venosos durante su administración.33,35 En la literatura, también podemos encontrar referencias en torno a evitar su administración en pacientes oncológicos por su potencial efecto tumorigénico, a pesar de presentar también efectos antitumorales colaterales.26
En conclusión, actualmente la gata con GECF refractaria de este caso clínico tratada con dos dosis celulares de AT-MSC, separadas 12 meses entre sí, como tratamiento coadyuvante al convencional, se ha mantenido estable con una reducción de los tratamientos farmacológicos habituales, así como una reducción de los signos clínicos iniciales y de las puntuaciones SDAI relativas a la inflamación, mejorando notablemente su calidad de vida en opinión de su propietaria tras 16 meses de seguimiento. Sin embargo, a pesar de esta mejoría, el caso sigue en estudio, ya que el objetivo de retirar completamente los tratamientos médicos aún no se ha conseguido, por lo que en futuras revisiones se podría plantear una tercera dosis celular en función de su evolución.
Fuente de financiación: este trabajo no se ha realizado con fondos comerciales, públicos o del sector privado.
Conflicto de intereses: los resultados parciales de este caso clínico fueron presentados en forma de comunicación póster en el pasado congreso de la South European Veterinary Conference (SEVC 2022) celebrado en Sevilla. El autor J.I. Gil-Chinchilla declara que es parte de la empresa SiCells-Veterinary Biotechnology que elaboró las dosis de AT-MSC para el tratamiento de la paciente, pero en ningún momento intervino en la evaluación y el seguimiento del caso clínico durante las revisiones realizadas a lo largo del estudio.
Bibliografía
- 1.
Lommer MJ: Efficacy of cyclosporine for chronic, refractory stomatitis in cats: A randomized, placebo-controlled, double-blinded clinical study. J Vet Dent. 2013; 30(1): 8-17.
[PubMed] - 2.
Kim DH, Kwak HH, Woo HM: Prevalence of feline chronic gingivostomatitis in feral cats and its risk factors. J Feline Med Surg. 2023; 25(1): 098612X221131453.
[PubMed] - 3.
Druet I, Hennet P: Relationship between Feline calicivirus Load, Oral Lesions, and Outcome in Feline Chronic Gingivostomatitis (Caudal Stomatitis): Retrospective Study in 104 Cats. Front Vet Sci. 2017; 4: 209.
[PubMed] - 4.
Kouki MI, Papadimitriou SA, Psalla D, Kolokotronis A, Rallis TS: Chronic Gingivostomatitis with Esophagitis in Cats. J Vet Intern Med. 2017; 31(6): 1673-1679.
[PubMed] - 5.
Lee D Bin, Verstraete FJM, Arzi B: An Update on Feline Chronic Gingivostomatitis. Vet Clin North Am Small Anim Pract. 2020; 50(5): 973-982.
[PubMed] - 6.
Villatoro AJ, Martín-Astorga MDC, Alcoholado C, et al. Altered Proteomic Profile of Adipose Tissue-Derived Mesenchymal Stem Cell Exosomes from Cats with Severe Chronic Gingivostomatitis. Animals (Basel). 2021; 11(8): 2466.
[PubMed] - 7.
Fried WA, Soltero-Rivera M, Ramesh A, et al. Use of unbiased metagenomic and transcriptomic analyses to investigate the association between feline calicivirus and feline chronic gingivostomatitis in domestic cats. Am J Vet Res. 2021; 82(5): 381-394.
[PubMed] - 8.
Peralta S, Carney PC: Feline chronic gingivostomatitis is more prevalent in shared households and its risk correlates with the number of cohabiting cats. J Feline Med Surg. 2019; 21(12): 1165-1171.
[PubMed] - 9.
Arzi B, Clark KC, Sundaram A, et al.: Therapeutic Efficacy of Fresh, Allogeneic Mesenchymal Stem Cells for Severe Refractory Feline Chronic Gingivostomatitis. Stem Cells Transl Med. 2017; 6(8): 1710.
[PubMed] - 10.
Winer JN, Arzi B, Verstraete FJM: Therapeutic management of feline chronic gingivostomatitis: A systematic review of the literature. Front Vet Sci. 2016; 3: 54.
[PubMed] - 11.
Nakanishi H, Furuya M, Soma T, et al.: Prevalence of microorganisms associated with feline gingivostomatitis. J Feline Med Surg. 2019; 21(2): 103-108.
[PubMed] - 12.
Jennings MW, Lewis JR, Soltero-Rivera MM, Brown DC, Reiter AM. Effect of tooth extraction on stomatitis in cats: 95 cases (2000-2013). J Am Vet Med Assoc. 2015; 246(6): 654-660.
[PubMed] - 13.
Arzi B, Mills-Ko E, Verstraete FJM, et al.: Therapeutic Efficacy of Fresh, Autologous Mesenchymal Stem Cells for Severe Refractory Gingivostomatitis in Cats. Stem Cells Transl Med. 2016; 5(1): 75-86.
[PubMed] - 14.
Druet I, Hennet P.: Relationship between Feline calicivirus Load, Oral Lesions, and Outcome in Feline Chronic Gingivostomatitis (Caudal Stomatitis): Retrospective Study in 104 Cats. Front Vet Sci. 2017; 4:1.
[PubMed] - 15.
Arzi B, Peralta S, Fiani N, et al.: A multicenter experience using adipose-derived mesenchymal stem cell therapy for cats with chronic, non-responsive gingivostomatitis. Stem Cell Res Ther. 2020; 11(1): 115.
[PubMed] - 16.
Arzi B, Taechangam N, Lommer MJ, et al.: Stem cell therapy prior to full-mouth tooth extraction lacks substantial clinical efficacy in cats affected by chronic gingivostomatitis. J Feline Med Surg. 2021; 23(6): 604-608.
[PubMed] - 17.
Oguzoglu TC, Koç BT, Yoldar ZA: Infección viral triple en el mismo gato: Feline Coronavirus, Feline Parvovirus, Feline Foamy Virus. Revista MVZ Córdoba. 2021; 26(3): 18.
- 18.
Koc BT, Oğuzoğlu TÇ: First report on the prevalence and genetic relatedness of Feline Foamy Virus (FFV) from Turkish domestic cats. Virus research. 2019; 274: 197768.
[PubMed] - 19.
Mestrinho LA, Travancinha J, Sobral C: A case report of leishmaniosis with primary oral manifestation in a cat. Front Vet Sci. 2022; 9: 1870.
[PubMed] - 20.
Dye C: Adipose-derived autologous mesenchymal stem cell transfusion for the treatment of feline chronic gingivostomatitis in a domestic shorthair cat. Veterinary Record Case Reports. 2020;8(3): e001198.
- 21.
Stathopoulou TR, Kouki M, Pypendop BH, et al.: Evaluation of analgesic effect and absorption of buprenorphine after buccal administration in cats with oral disease. J Feline Med Surg. 2018; 20(8): 704-710.
[PubMed] - 22.
Corbee RJ, Booij-Vrieling HE, van de Lest CHA, et al.: Inflammation and wound healing in cats with chronic gingivitis/stomatitis after extraction of all premolars and molars were not affected by feeding of two diets with different omega-6/omega-3 polyunsaturated fatty acid ratios. J Anim Physiol Anim Nutr (Berl). 2012; 96(4): 671-680.
[PubMed] - 23.
Voga M, Adamic N, Vengust M, Majdic G: Stem cells in veterinary medicine—current state and treatment options. Frontiers in veterinary science. 2020; 7: 278.
[PubMed] - 24.
Dias IE, Pinto PO, Barros LC, et al.: Mesenchymal stem cells therapy in companion animals: useful for immune-mediated diseases? BMC Vet Res. 2019; 15(1): 1-4.
[PubMed] - 25.
Quimby JM, Borjesson DL: Mesenchymal stem cell therapy in cats: Current knowledge and future potential. J Feline Med Surg. 2018; 20(3): 208-216.
[PubMed] - 26.
Musiał-Wysocka A, Kot M, Majka M: The Pros and Cons of Mesenchymal Stem Cell-Based Therapies. Cell Transplant. 2019; 28(7): 801-812.
[PubMed] - 27.
Thomson AL, Berent AC, Weisse C, Langston CE: Intra-arterial renal infusion of autologous mesenchymal stem cells for treatment of chronic kidney disease in cats: Phase I clinical trial. J Vet Intern Med. 2019; 33(3):1353-1361.
[PubMed] - 28.
Srinivasan VM, Gumin J, Camstra KM, et al.: Endovascular Selective Intra-Arterial Infusion of Mesenchymal Stem Cells Loaded With Delta-24 in a Canine Model. Neurosurgery. 2020; 88(1): E102-E113.
[PubMed] - 29.
Sole A, Spriet M, Galuppo LD, et al.: Scintigraphic evaluation of intra-arterial and intravenous regional limb perfusion of allogeneic bone marrow-derived mesenchymal stem cells in the normal equine distal limb using (99m) Tc-HMPAO. Equine Vet J. 2012; 44(5): 594-599.
[PubMed] - 30.
Trela JM, Spriet M, Padgett KA, et al.: Scintigraphic comparison of intra-arterial injection and distal intravenous regional limb perfusion for administration of mesenchymal stem cells to the equine foot. Equine Vet J. 2014; 46(4): 479-483.
[PubMed] - 31.
Ankrum JA, Ong JF, Karp JM: Mesenchymal stem cells: immune evasive, not immune privileged. Nat Biotechnol. 2014; 32(3): 252.
- 32.
Weiss ARR, Dahlke MH: Immunomodulation by Mesenchymal Stem Cells (MSCs): Mechanisms of action of living, apoptotic, and dead MSCs. Front Immunol. 2019; 10: 1191.
[PubMed] - 33.
Moll G, Ignatowicz L, Catar R, et al.: Different Procoagulant Activity of Therapeutic Mesenchymal Stromal Cells Derived from Bone Marrow and Placental Decidua. Stem Cells Dev. 2015; 24(19): 2269-2279.
[PubMed] - 34.
Norte-Muñoz M, Gallego-Ortega A, Lucas-Ruiz F, et al.: Immune recognition of syngeneic, allogeneic and xenogeneic stromal cell transplants in healthy retinas. Stem Cell Res Ther. 2022; 13(1): 430.
[PubMed] - 35.
Wang Y, Yi H, Song Y: The safety of MSC therapy over the past 15 years: a meta-analysis. Stem Cell Res Ther. 2021;12(1): 1-5.
[PubMed] - 36.
Febre M, Maddens S, Robert C, et al.: Single infusion of allogeneic neonatal Mesenchymal stromal cells to manage refractory feline gingivostomatitis- A clinical pilot study. Cytotherapy 2020; 22(5), S102.
- 37.
Soltero-Rivera M, Hart S, Blandino A, et al.: Mesenchymal stromal cells therapy for feline chronic gingivostomatitis: Long term experience. Front Vet Sci. 2023;10(4): 433-441.
[PubMed]