Caso clínico de… Urgencias
M. Solana, C. Gómez-Ullate, J.L. Puchol, A. Segarra
Contacto: solanamiriam@yahoo.es
Historia
Acudió a consulta una hembra castrada de samoyedo de 6 años, tras mostrar un cuadro de vómitos, hiporexia y fiebre de una semana de evolución. El animal presentaba una pauta de vacunación y desparasitación adecuada y no tenía acceso a tóxicos.
En la exploración física general se detectó dolor moderado en la palpación abdominal, temperatura rectal de 39,5 ºC e ictericia. El resto de la exploración se encontraba dentro de la normalidad.
Para comenzar con el protocolo diagnóstico se realizó una analítica de sangre que incluyó hemograma completo con recuento diferencial de leucocitos (Tabla 1), bioquímica sanguínea y tiempos de coagulación (Tablas 2 y 3).
*Valores fuera de rango.
MCHC: concentración media de hemoglobina corpuscular; MCV: volumen corpuscular medio.
*Valores fuera de rango.
ALP: fosfatasa alcalina; ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; GGT: gamma-glutamiltransferasa; PT: proteínas totales.
aPTT: tiempo de tromboplastina parcial activado; TP: tiempo de protrombina
En el hemograma se observó una leve neutrofilia y una trombocitosis moderada. La bioquímica mostraba una elevación generalizada de las enzimas hepáticas (ALT, AST, GGT y ALP) junto con hipercloremia, hipertrigliceridemia e hiperbilirrubinemia. Los tiempos de coagulación se encontraban en rango.
Como pruebas complementarias se realizó un urianálisis que reveló bilirrubinuria y bacteriuria con abundantes bacilos intra y extracelulares en el sedimento, por lo que se remitió una muestra de orina (IDEXX, Madrid, España) para la realización de un cultivo de orina con antibiograma que dio como resultado una infección causada por Escherichia coli (≥1 x 105 UFC/ml) y Enterococcus faecalis (8 x 104 UFC/ml), ambas sensibles a amoxicilina/clavulánico.
En base a las pruebas realizadas, ¿cuáles son tus diagnósticos diferenciales?
Entre los diagnósticos diferenciales de dolor abdominal e ictericia debemos incluir las causas hepáticas: colangitis/colangiohepatitis, lipidosis hepática, hepatitis crónica, cirrosis, fallo hepático y neoplasias hepáticas, entre otras. En el segundo grupo figuran las causas poshepáticas u obstrucciones del flujo biliar: mucocele biliar, obstrucción parcial o completa del drenaje de la bilis secundaria a presencia de colelitos o estenosis, pancreatitis, enteritis grave y las neoplasias de vías biliares, pancreáticas o intestinales que obstruyen el flujo de salida de la bilis del conducto biliar común al duodeno a través de la papila duodenal.1
Existen otras causas de ictericia, las denominadas prehepáticas o hemolíticas, como la anemia hemolítica inmunomediada, las intoxicaciones (p. ej., cebolla, plomo, etc.) y las enfermedades infecciosas, las cuales resultan poco probables tras la anamnesis, la exploración física del animal y las pruebas analíticas.1
¿Qué otras técnicas de diagnóstico realizarías para alcanzar un diagnóstico definitivo?
Las pruebas de imagen, tales como la radiografía y la ecografía abdominal resultan de utilidad en el diagnóstico diferencial de la ictericia y la elevación generalizada de enzimas hepáticas.2
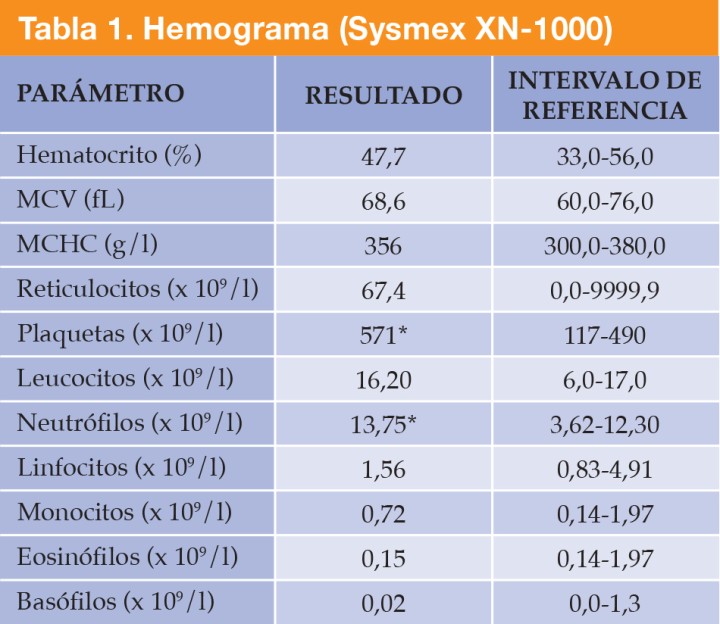
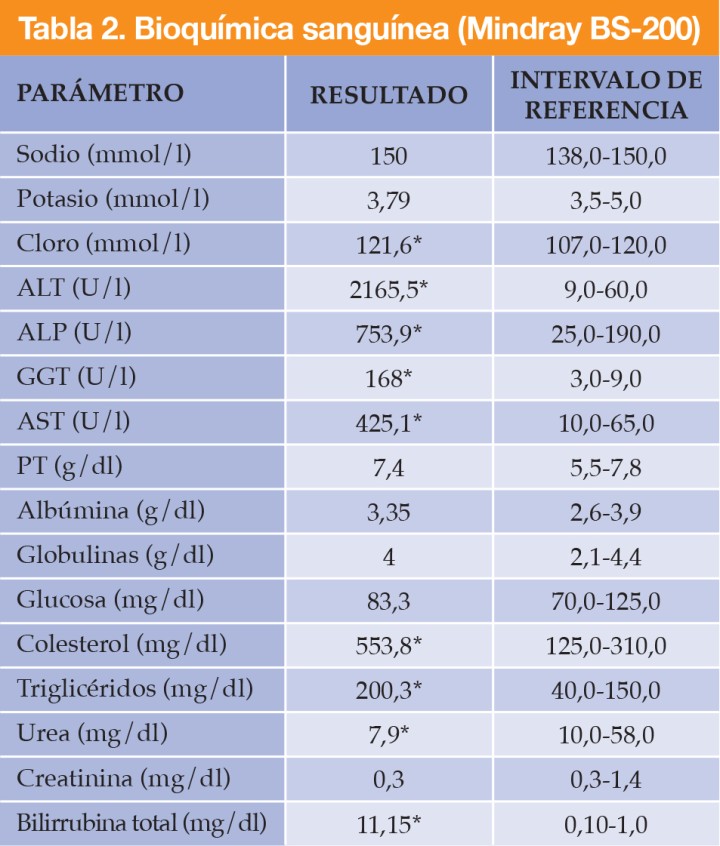
Se realizaron radiografías de la cavidad abdominal, con proyecciones lateral derecha y ventrodorsal (Fig. 1). En la proyección lateral se identificaron múltiples estructuras de opacidad mineral en la región de proyección de la silueta hepática (Fig. 1A) detectándose, además, otra estructura de la misma opacidad con morfología ovalada, bordes irregulares y espiculados situada en el abdomen craneal derecho (Fig. 1B).
Figura 1
Estudio radiográfico de abdomen con proyección lateral derecha (A) donde se identifican múltiples estructuras de opacidad mineral (círculo blanco) en la región de la silueta hepática y una estructura de la misma opacidad con morfología ovalada y bordes irregulares y especulados situada en el abdomen craneal derecho (*), como se observa también en la proyección ventrodorsal (B).
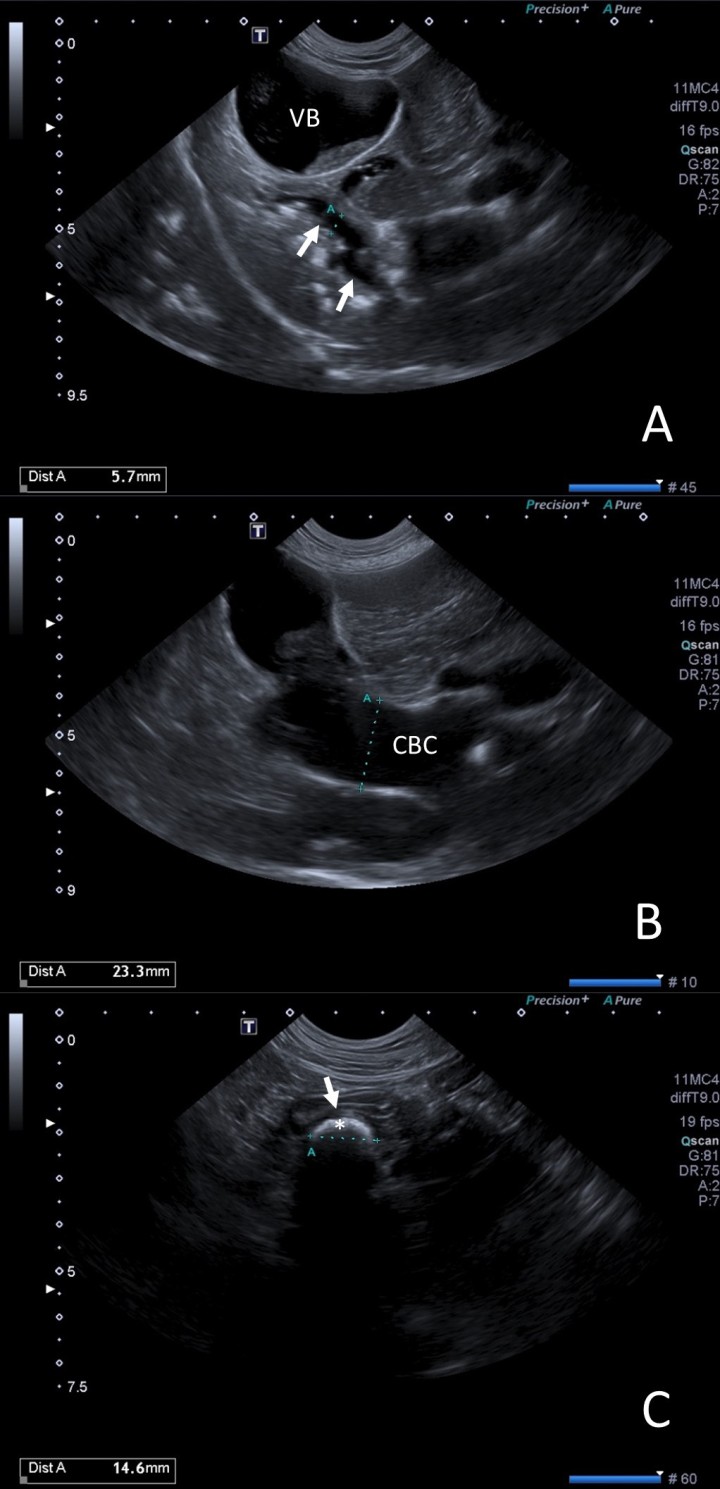
Para localizar y caracterizar dichas estructuras radiopacas detectadas, así como valorar el hígado y las vías biliares se llevó a cabo una ecografía abdominal (Fig. 2). El estudio ecográfico reveló un parénquima hepático hiperecogénico con bordes redondeados. Las vías biliares intrahepáticas estaban dilatadas con abundante sedimento y múltiples pequeñas estructuras hiperecoicas que generaban sombra acústica. La vesícula biliar se encontraba distendida con moderada cantidad de sedimento biliar, pero sin colelitos visibles en su interior en el momento del estudio (Fig. 2A). La pared de la vesícula biliar (VB) presentó un leve aumento en su espesor (3 mm). El conducto biliar común (CBC) se encontraba marcadamente distendido (23 mm) en toda su longitud (Fig. 2B) hasta alcanzar una estructura hiperecoica de 14 mm x 9 mm con sombra acústica que obstruía completamente la luz del colédoco; dicha estructura se encontraba inmediatamente craneal a la papila duodenal (Fig. 2C).
Figura 2
(A) Se observa la vesícula biliar (VB) distendida con contenido en su interior, así como dilatación de las vías biliares intrahepáticas (flechas) con pequeñas estructuras hiperecogénicas que causan sombra acústica. (B) Conducto biliar común (CBC) marcadamente distendido. (C) Conducto biliar común a su llegada a la papila duodenal (flecha), donde se observa una estructura hiperecoica (*) de gran tamaño responsable de la obstrucción.
Adicionalmente, se realizó una colecistocentesis para cultivo con antibiograma de la bilis (IDEXX, Madrid, España), presentando ausencia de crecimiento bacteriano y/o fúngico tras un periodo de incubación de 7 días en los correspondientes medios de cultivo en condiciones de aerobiosis/anaerobiosis.
Tras realizar estas pruebas, se confirmó que la ictericia de nuestra paciente estaba producida por una obstrucción completa de las vías biliares extrahepáticas.
¿Cuáles son las opciones terapéuticas en estos casos?
Existen pocos estudios previos del manejo médico de la colelitiasis en perros, por lo que la evidencia clínica resulta limitada. No existe un consenso actual sobre el tratamiento médico de animales con colelitiasis.3 A menudo se prescribe ácido ursodesoxicólico debido a su acción como colerético, ya que la formación de algunos colelitos depende de la precipitación de sales de bilirrubinato cálcico y formación de mucina asociada a la inflamación, hipomotilidad y estasis biliar.4,5
En los casos en que la obstrucción biliar es completa, se recomienda el tratamiento quirúrgico debido al elevado riesgo de peritonitis biliar asociada a ruptura de la vesícula biliar o del conducto biliar común.6
La colecistectomía se considera el tratamiento de elección para la coledocolitiasis obstructiva si los coledocolitos se pueden masajear hasta la vesícula biliar y siempre que el conducto colédoco sea permeable.7
La coledocotomía simple fue la técnica quirúrgica empleada en nuestro caso para resolver la obstrucción, ya que el cálculo no podía desplazarse manualmente hasta la vesícula biliar; además se realizaron biopsias hepáticas para completar el diagnóstico.
En algunos casos, se realiza de forma adicional una duodenotomía antimesentérica para facilitar mediante flushing el flujo retrógrado de la bilis en el conducto biliar común.8
Existe una técnica novedosa que consiste en la colocación de un stent intraluminal vía endoscópica en el extremo distal del conducto biliar común. Solo existe un caso de éxito publicado hasta el momento, por lo que se considera necesaria la recopilación de resultados a corto y largo plazo antes de que este procedimiento pueda ser recomendado.9
El cálculo extraído se analizó en el laboratorio, el resultado fue un cálculo pigmentado de color negro, de 15 x 10 mm de tamaño, de composición 100 % carbonato cálcico sin microorganismos presentes en el mismo (Fig. 3).
Figura 3
Cálculo pigmentado de color negro, de 15 x 10 mm de tamaño extraído mediante coledocotomía.
El examen histológico de las muestras hepáticas confirmó cambios consistentes con la presencia de colestasis/colangiohepatitis neutrofílica crónica, una degeneración vacuolar glucogénica, además de zonas de fibrosis leve en las regiones periportales y adyacentes a los conductillos biliares.
¿Cuál es el pronóstico a corto y medio plazo?
Históricamente, las enfermedades de las vías biliares extrahepáticas se han asociado con una morbilidad y mortalidad relativamente altas en perros, con tasas de mortalidad reportadas entre el 22 y el 64 %.10,11
Se ha observado que los perros que sobreviven al período posoperatorio temprano después de una cirugía biliar generalmente tienen un buen pronóstico a largo plazo.10 Las anomalías en la funcionalidad hepática en el preoperatorio constituyen un factor de riesgo en la supervivencia de estos pacientes. Las elevaciones de la ALT, GGT y bilirrubina reflejan la gravedad de la colestasis que produce la disminución en la eliminación de bacterias por el hígado, predisponiendo a los pacientes a infecciones y sepsis.10 Las complicaciones más comunes en el posoperatorio temprano incluyen dolor, dehiscencia, peritonitis biliar o pancreatitis, entre otras, y en casos más graves disnea producida por tromboembolismo pulmonar, neumonía por aspiración, así como síndrome agudo de distrés respiratorio, asociado generalmente a enterotoxemia y sepsis.12
Nuestra paciente estuvo hospitalizada en la Unidad de Cuidados Intensivos con tratamiento intravenoso (IV) a base de protectores hepáticos (acetilcisteína, 70 mg/kg, IV dos veces al día, Laboratorios Zambón, Barcelona), antibioterapia de amplio espectro (amoxicilina/clavulánico 22 mg/kg IV tres veces al día, Laboratorios Normon, Madrid) y analgesia (metamizol magnésico, 25 mg/kg IV tres veces al día, Laboratorios Normon, Madrid; e infusión continua de lidocaína, 3 mg/kg/h IV, Laboratorios B.Braun, Barcelona). Se observó mejoría clínica, analítica y ecográfica en las posteriores revisiones, dándose el alta a los 4 días del ingreso con una dieta baja en grasa y en tratamiento con ácido ursodesoxicólico (10 mg/kg/24 h vía oral, Laboratorios Estedi S.L., Barcelona).
Discusión
La coledocolitiasis es una patología poco común en el perro. La patogénesis en la especie canina es desconocida, pero se ha considerado que algunas causas de formación de colelitos puedan ser: el estasis o la discinesia de la vesícula biliar, las alteraciones dietéticas o enfermedades metabólicas/endocrinas que cursen con hipercolesterolemia, hipertrigliceridemia o defectos de la absorción y transporte del calcio y colesterol en la vesícula biliar, así como las colecistitis bacterianas o parasitarias.13
Las opciones terapeúticas descritas para esta enfermedad incluyen el manejo médico o médico-quirúrgico, habiendo mostrado la resolución completa el tratamiento médico-quirúrgico, y siendo de gran importancia el manejo del dolor visceral.4
La obstrucción del tracto biliar extrahepático en perros es especialmente dolorosa, por lo que el manejo del dolor es esencial en el tratamiento de esta enfermedad y debe estar formulado de manera individualizada para cada animal, ya sea empleando analgésicos más potentes como los opioides (en dosis únicas o infusión continua), analgésicos no opioides (p. ej., AINEs, metimazol) o técnicas regionales (p. ej., infusión continua de anestésicos locales con catéter epidural).1
Los cálculos biliares pueden clasificarse en función de su composición bioquímica y su coloración. Los cálculos formados principalmente de bilirrubina suelen presentar un pigmento negro, los cálculos de bilirrubinato de calcio por lo general muestran un pigmento marronáceo y los cálculos de colesterol suelen ser no pigmentados. Nuestra paciente presentaba un cálculo de color negro y superficie rugosa con una composición única de carbonato cálcico. En la especie humana la formación de estos cálculos se debe a una condición de la bilis denominada limy bile o bilis calcárea.14 Existen varias teorías que pueden explicar esta condición. Por un lado, podría deberse al bloqueo en el flujo biliar debido a cálculos ya presentes en el conducto biliar común, alteraciones en el pH biliar (pH biliar ácido) o a alteraciones en el metabolismo del calcio.
El calcio puede formar complejos de sales biliares que son insolubles y, en presencia de patologías primarias en la vesícula biliar, estos complejos precipitan y forman estos cálculos.14
La obstrucción del flujo biliar extrahepático por la presencia de un colelito en el conducto biliar común es poco frecuente en la especia canina, constituyendo situaciones de urgencia médica. Identificar y abordar esta condición de forma rápida y eficiente puede evitar el desarrollo de complicaciones que pongan en riesgo la vida del animal.
Fuente de financiación: este trabajo no se ha realizado con fondos comerciales, públicos o del sector privado.
Conflicto de interés: los autores declaran que no existe conflicto de intereses.
Bibliografía
- 1.
Watson PJ: Manifestaciones clínicas de la enfermedad hepatobiliar y pancreática. En: Nelson RW, Couto CG: Medicina interna de pequeños animales. Sexta edición 2020. Grupo Asís Biomedia SL.
- 2.
Allan F, Watson PJ, McCallum KE: Clinical features and outcomes in 38 dogs with cholelithiasis receiving conservative or surgical management. J Vet Intern Med 2021; 35: 2730-2742.
[PubMed] - 3.
Ward PM, Brown K, Hammond G, et al.: Cholelithiasis in the dog: prevalence, clinical presentation, and outcome. J Am Anim Hosp Assoc 2020; 56: 152.
[PubMed] - 4.
Center SA: Diseases of the gallbladder and biliary tree. Vet Clin North Am Small Anim Pract 2009; 39: 543-598.
[PubMed] - 5.
Brömel C, Barthez PY, Léveillé R, Scrivani PV: Prevalence of gallbladder sludge in dogs as assessed by ultrasonography. Vet Radiol Ultrasound 1998; 39: 206-221.
[PubMed] - 6.
Allan F, Watson PJ, McCallum KE: Clinical features and outcomes in 38 dogs with cholelithiasis receiving conservative or surgical management. J Vet Intern Med 2021; 35: 2730-2742.
[PubMed] - 7.
Folk C, Lux C: Choledochotomy for obstructive choledocholithiasis in two dogs. Case Rep Vet Med 2019. 4748194.
[PubMed] - 8.
Baker S, Mayhew P, Mehler S: Choledochotomy and primary repair of extrahepatic biliary duct rupture in seven dogs and two cats. J Small Anim Pract 2011; 52: 32-37.
[PubMed] - 9.
Berent A, Weisse C, Schattner M, et al.: Initial experience with endoscopic retrograde cholangiography and endoscopic retrograde biliary stenting for treatment of extrahepatic bile duct obstruction in dogs. J Am Vet Med Assoc 2015; 246: 436-446.
[PubMed] - 10.
Amsellem PM, Seim HB, MacPhail CM, et al.: Long-term survival and risk factors associated with biliary surgery in dogs: 34 cases (1994–2004). J Am Vet Med Assoc 2006; 229: 1451-1457.
[PubMed] - 11.
Mehler SJ, Mayhew PD, Drobatz KJ, Holt DE: Variables associated with outcome in dogs undergoing extrahepatic biliary surgery: 60 cases (1988–2002). Vet Surg 2004; 33: 644-649.
[PubMed] - 12.
Carpenter D, Macintire DK, Tyler JW: Acute lung injury and acute respiratory distress syndrome. 2Compend Contin Educ Vet 2001; 23: 712-727.
- 13.
Kirpensteijn J, Fingland R, Ulrich T, Sikkema D, Allen S, Cholelithiasis in dogs: 29 cases (1980-1990). J Am Vet Med Assoc 1993; 202: 1137-1142.
[PubMed] - 14.
Arif SH, Mohammed AA: Limy bile (Milk of calcium bile) associated with gall stones discovered incidentally during laparoscopic cholecystectomy. Int J Surg Case Rep 2019; 61: 127-129.
[PubMed]