Pérdida de consciencia en consulta de un paciente canino secundaria a rotura del atrio izquierdo
Loss of consciousness in a canine patient secondary to left atrial rupture
O. Monge-Utrilla, N. de Andrés-Fernández
Contacto: omongeutrilla@gmail.com
Resumen
La ruptura del atrio izquierdo es un hallazgo con baja prevalencia en medicina veterinaria, siendo una complicación grave de la enfermedad crónica degenerativa de la válvula mitral (ECDVM). Esta se produce en pacientes que presentan una sobrecarga severa y crónica del atrio izquierdo, pudiendo llegar a causar un taponamiento pericárdico y la muerte del paciente. En este caso la rotura de la pared del atrio izquierdo se produce durante la manipulación del paciente en la clínica veterinaria permitiendo responder de forma rápida y valorar la necesidad de realizar una pericardiocentesis. Debido a no observar signos de taponamiento cardíaco se decide no realizar el drenaje del derrame pericárdico, permitiendo la formación de un coágulo que tapone la rotura de la pared atrial. Tras 24 horas de hospitalización y seguimiento ecográfico continuo del paciente, se realiza el alta con el tratamiento estándar para la enfermedad crónica degenerativa de la válvula mitral permitiendo una supervivencia del paciente de 197 días.
Palabras clave: cardiología, urgencias, ecocardiografía, atrio izquierdo, rotura.
Clin Vet Peq Anim 2024, 44 (1): 11 -14
Summary
Left atrial rupture is a finding with low prevalence in veterinary medicine, being a serious complication of chronic degenerative mitral valve disease (MCDVM). This occurs in patients who present a severe and chronic overload of the left atrium, which can cause pericardial tamponade and death of the patient. In this case, rupture of the wall of the left atrium occurred during handling of the patient at the veterinary practice, allowing a rapid response and assessment of the need to perform pericardiocentesis. As no signs of cardiac tamponade were observed, it was decided not to drain the pericardial effusion, allowing the formation of a clot that plugged the defect in the atrial wall. After 24 hours of hospitalization and continuous ultrasound monitoring of the patient, the patient was discharged with the standard treatment for chronic degenerative mitral valve disease, allowing the patient to survive for 197 days.
Keywords: cardiology, emergency, echocardiography, left atrium, rupture.
Clin Vet Peq Anim 2024, 44 (1): 11 -14

La presencia de este logo en un artículo de la revista indica que se publicará un examen sobre el mismo en la plataforma AVEPA Elearning. Su resolución aporta 0,15 créditos dentro del sistema de acreditaciones de especialidades veterinarias de AVEPA.
Introducción
La rotura del atrio izquierdo es un hallazgo con baja prevalencia en medicina veterinaria siendo solo el 2 % de los casos de derrame pericárdico debidos a esta causa.1 Se trata de una complicación grave de la enfermedad crónica degenerativa de la válvula mitral (ECDVM).2
Con la rotura de la pared del atrio izquierdo se produce un derrame pericárdico subagudo, pudiendo provocar taponamiento cardíaco y shock cardiogénico, debido al descenso en el gasto cardíaco y la presión arterial, y un aumento de la presión venosa sistémica y pulmonar;2 en algunas ocasiones esto conlleva la muerte del animal.
Los signos clínicos más frecuentes son disnea, tos, debilidad, pérdida de consciencia y muerte súbita.2,3 El diagnóstico se realiza mediante ecocardiografía, pudiendo observar, además de la presencia de derrame pericárdico, una estructura hiperecoica adherida a la pared del atrio izquierdo (AI) compatible con un coágulo.1 El objetivo de este artículo es mostrar el manejo y las posibles opciones terapéuticas en casos de rotura de la pared del atrio izquierdo en pacientes con enfermedad crónica degenerativa de la válvula mitral.
Descripción del caso clínico
Se presentó en consulta de cardiología un paciente canino, de raza bichón maltés, castrado y de 9 años de edad. El motivo de la consulta fue la presencia de taquipnea leve, disnea mixta con refuerzo abdominal, intolerancia al ejercicio e hiporexia.
En la exploración física se detectó un soplo pansistólico, grado VI, con punto de máxima intensidad en el área de proyección de la válvula mitral e irradiación a todos los cuadrantes de auscultación en ambos hemitórax. En la auscultación pulmonar observamos la presencia de crepitaciones húmedas en ambos hemitórax y refuerzo de los ruidos respiratorios. El paciente presentaba taquicardia y taquipnea leve, sin posición ortopneica.
Ecocardiográficamente se observó una dilatación severa del atrio izquierdo (AI) (ratio aorta/atrio izquierdo4 de 3,88; diámetro normalizado del atrio izquierdo5 de 26,91) y dilatación del ventrículo izquierdo (diámetro interno del ventrículo izquierdo normalizado en diástole6 de 2,28) secundarios a un engrosamiento, fallo de coaptación y prolapso de las valvas de la válvula mitral, determinando una regurgitación mitrálica posterior grave. Se realizó radiología torácica para valorar la presencia de edema pulmonar, observando un patrón intersticial-alveolar severo en el área perihiliar y en los lóbulos caudales pulmonares, compatible con la presencia de edema pulmonar de origen cardiogénico. Tras la realización de la radiografía torácica, se diagnosticó ECDVM en estadio C7 agudo, con una puntuación ecocardiográfica de la insuficiencia mitral (MINE)8 de 12. No se observó derrame pericárdico durante la realización del examen (Figs. 1 y 2).
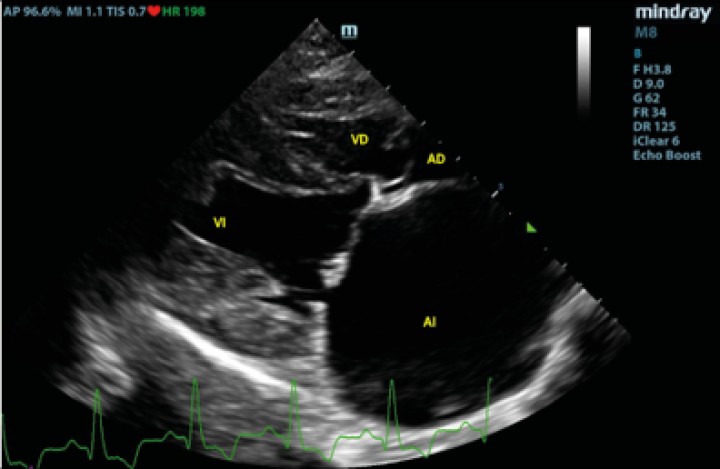
Figura 1
Corte paraesternal derecho 4 cámaras, previo a la rotura del atrio izquierdo. VI: ventrículo izquierdo; VD: ventrículo derecho; AI: atrio izquierdo; AD: atrio derecho.
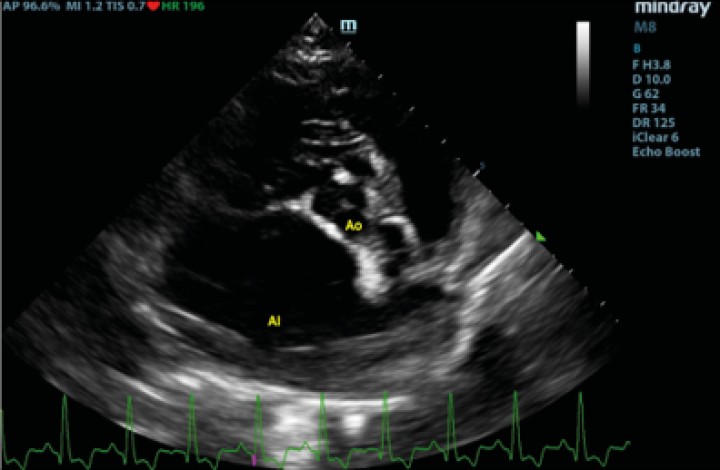
Figura 2
Corte paraesternal derecho transversal a la altura del atrio izquierdo y aorta, previo a la rotura del atrio izquierdo. Ao: aorta; AI: atrio izquierdo.
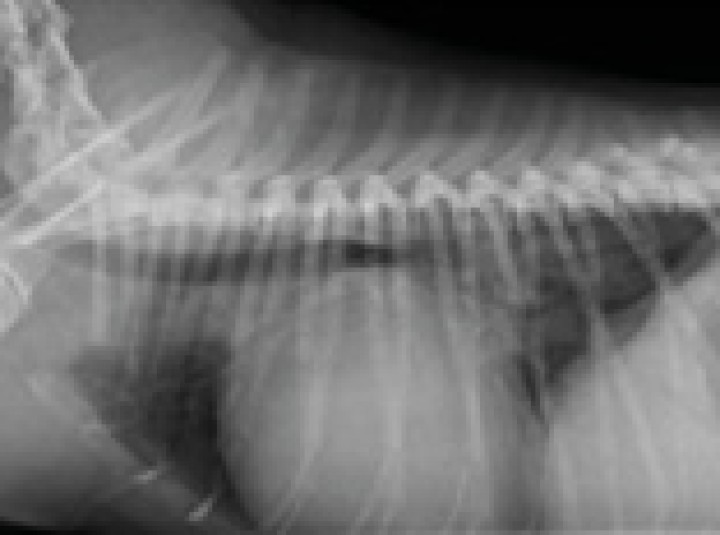
Durante la realización de las radiografías torácicas (Fig. 3), el paciente sufrió una pérdida de consciencia, rigidez y cambio de coloración de las mucosas (cianosis). En la auscultación, los ruidos cardíacos se encontraban disminuidos y el pulso femoral se notaba más débil y rápido respecto a lo observado en la exploración física previa al examen ecocardiográfico. Debido al estado inestable del paciente se optó por iniciar un tratamiento de soporte sin la realización de otras pruebas complementarias. Se comenzó el tratamiento de soporte con oxigenoterapia y fluidoterapia basada en cristaloides calculada como un bolo de 2 ml/kg administrado en 15 minutos, monitorización del electrocardiograma donde se observó la presencia de taquicardia sinusal a 185 latidos por minuto, y medición de la presión arterial de forma no invasiva, con valores de presión sistólica de 85 mmHg compatibles con hipotensión.
Figura 3
Radiografía torácica latero-lateral derecha realizada en el momento que se produjo la rotura del atrio izquierdo.
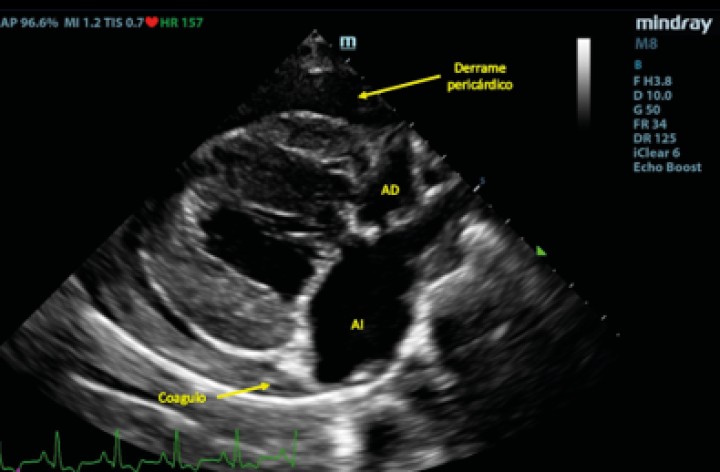
Posteriormente se evaluó al paciente mediante un examen TFAST, detectando derrame pericárdico y disminución del tamaño del AI (Fig. 4), como hallazgos diferentes a los observados en el examen realizado previo a la radiografía. La rápida respuesta por parte del equipo veterinario implicó que en este primer examen ecográfico tras el desvanecimiento del paciente no se había producido la formación del coágulo para taponar la fisura de la pared, observando flujo desde el AI hacia el saco pericárdico. Se realizaron exámenes TFAST seriados para evaluar la necesidad de realizar una pericardiocentesis al paciente durante la hora siguiente al episodio. En los exámenes seriados realizados no se observaron signos ecocardiográficos de taponamiento cardíaco, por lo que se decidió no realizar un vaciado del contenido pericárdico mediante pericardiocentesis9,10 y se optó por un tratamiento de soporte basado en oxigenoterapia y fluidoterapia, buscando mantener un correcto gasto cardíaco sin aumentar en exceso la presión sistólica del paciente, lo que podría producir un aumento del sangrado a través del defecto de la pared atrial, así como una dosis única de pimobendán (Vetmedin, Boehringer Ingelheim, Rhein) por vía intravenosa a 0,15 mg/kg. A los 15 minutos tras el episodio de desvanecimiento, se observó la presencia de una estructura hiperecoica en la pared del AI en el examen ecográfico, compatible con la formación de un coágulo (Fig. 5).
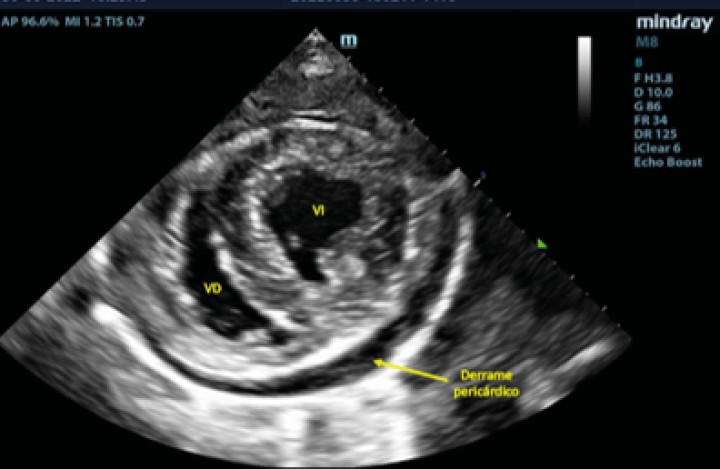
Figura 4
Examen TFAST tras la rotura del atrio izquierdo donde podemos observar un corte transversal del corazón a la altura de los músculos papilares de ventrículo izquierdo. Se puede observar la presencia de derrame pericárdico. VD: ventrículo derecho; VI: ventrículo izquierdo.
Figura 5
Corte paraesternal derecho 4 cámaras tras la rotura del atrio izquierdo. Se puede observar la formación de una estructura compatible con un coágulo dentro del saco pericárdico. AD: atrio derecho; AI: atrio izquierdo.
En este caso, se produjo la rotura del AI durante la manipulación del paciente al realizar el examen radiológico, pudiendo obtener imágenes ecocardiográficas y radiológicas que nos permitieron realizar un diagnóstico precoz y seguimiento exhaustivo del paciente.
Se mantuvo hospitalizado al paciente 24 horas con exámenes ecográficos cada hora, pudiendo realizar el alta hospitalaria y un control posterior de la ECDVM mediante terapia farmacológica por vía oral con torasemida 0,2 mg/kg cada 12 horas (Isemid, Ceva Santé Animale, Libourne), pimobendán 0,25 mg/kg cada 12 horas (Vetmedin, Boehringer Ingelheim, Rhein), espironolactona 2 mg/kg cada 12 horas, y benazepril 0,25 mg/kg cada 12 horas (Cardalis, Ceva Santé Animale, Libourne).
Tras el alta, el paciente presentó una supervivencia de 197 días, momento en el que se produjo una nueva descompensación de la ECDVM y se decidió realizar la eutanasia humanitaria por petición de los tutores del paciente.
Discusión
Nuestro paciente sufrió una pérdida de consciencia transitoria que podría haberse debido a la presencia de un síncope, una crisis convulsiva o un episodio de debilidad transitoria.11 Debido al historial clínico del paciente, las pruebas realizadas previas al episodio y los signos clínicos observados, decidimos descartar inicialmente que se hubiera producido una crisis convulsiva y realizamos pruebas para descartar las posibles causas de un síncope o un episodio de debilidad transitoria. Se valoraron principalmente las causas cardiovasculares que pueden producirlos mediante la realización de un examen TFAST, monitorización del electrocardiograma y medición de la presión arterial de forma no invasiva. Se obtuvo un diagnóstico de rotura de la pared lateral del AI con presencia de derrame pericárdico subagudo e hipotensión arterial sistémica, sin alteraciones que justificasen el episodio en el electrocardiograma. Así pues, se determinó que este derrame pericárdico secundario a la rotura del AI era la causa más probable del episodio de pérdida de consciencia transitoria o síncope, por disminución del gasto cardíaco de forma abrupta.11
La rotura del AI es una complicación rara y grave de la ECDVM durante la manipulación clínica del paciente. En muchas ocasiones se sospecha de rotura de la pared del atrio izquierdo debido a la presencia de dilatación severa del mismo, presencia de derrame pericárdico y la detección de una estructura compatible con un coágulo adherido a la pared del AI. En nuestro caso pudimos corroborar esta complicación, ya que disponíamos de imágenes ecocardiográficas previas y posteriores a la rotura con minutos de diferencia.
Esta complicación debe ser tratada de urgencia y monitorizada teniendo en cuenta los signos hemodinámicos del paciente en la toma de decisiones terapéuticas, evaluando la necesidad de realizar pericardiocentesis solo ante la presencia de taponamiento pericárdico,9,10 y realizando un tratamiento de soporte que asegure un gasto cardíaco adecuado para el paciente mediante tratamiento médico.
Debido a que el pronóstico de esta complicación tratada de forma médica es malo1,12 se ha evaluado el uso de la cirugía para el cierre de la rotura de la pared atrial,13,14 en conjunto o no con la reparación de la válvula mitral mediante la técnica de la anuloplastia.14 Esta técnica está asociada a una tasa de supervivencia elevada y evita la posibilidad de recidivas de la rotura de la pared atrial al realizar la reparación de la válvula mitral y eliminar la insuficiencia valvular.14 Es por esto que esta opción terapéutica debería tenerse en cuenta en los centros donde se disponga de los medios necesarios para la realización de este tipo de cirugías.
La rotura del AI presenta un mal pronóstico para el paciente,1 con una alta tasa de mortalidad principalmente durante la primera semana desde la rotura de la pared atrial.12 Se ha observado una mayor tasa de mortalidad a corto plazo si lo comparamos con otras patologías como las neoplasias cardíacas, que también pueden producir derrames pericárdicos hemorrágicos con riesgo de taponamiento pericárdico subagudo.15
Sin embargo, se ha observado que, si el paciente sobrevive a esta primera semana desde la rotura de la pared atrial, el pronóstico mejora, pudiendo llegar a tener un tiempo de supervivencia de 427 días, similar a otros pacientes con ECDVM sin rotura de la pared atrial.12
En nuestro caso el tiempo de supervivencia tras la rotura de la pared atrial fue de 197 días; este tiempo de supervivencia es menor respecto al estudio referenciado anteriormente y esto puede deberse a que el paciente se encontraba en insuficiencia cardíaca congestiva en el momento de la rotura de la pared atrial, siendo un factor pronóstico negativo según se ha observado en estudios publicados anteriormente.16
Fuente de financiación: este trabajo no se ha realizado con fondos comerciales, públicos o del sector privado.
Conflicto de intereses: los autores declaran que no existe conflicto de intereses.
Bibliografía
- 1.
Reineke EL, Burkett DE, Drobatz KJ. Left atrial rupture in dogs: 14 cases (1990–2005). J Vet Emerg Crit Care. 2008; 18(2): 158-64.
- 2.
Romito G, Testa F, Cipone M. Suspected sequential left atrial ruptures in a dog with myxomatous mitral valve disease. J Vet Cardiol 2022; 44: 18-22.
[PubMed] - 3.
Han D, Jung D. A Case of Suspected Pericardial Effusion caused by Left Atrial Rupture due to Myxomatous Mitral Valve Degeneration. J Vet Clin 2020; 37(3): 153-156.
- 4.
Hansson K, Häggström J, Kvart C, Lord P. Left atrial to aortic root indices using two-dimensional and M-mode echocardiography in cavalier King Charles spaniels with and without left atrial enlargement. Vet Radiol Ultrasound 2002; 43(6): 568-575.
[PubMed] - 5.
Marchesotti F, Vezzosi T, Tognetti R, et al. Left atrial anteroposterior diameter in dogs: reference interval, allometric scaling, and agreement with the left atrial-to-aortic root ratio. J Vet Med Sci 2019; 81(11): 1655-1662.
[PubMed] - 6.
Cornell CC, Kittleson MD, Della Torre P, et al. Allometric scaling of M-mode cardiac measurements in normal adult dogs. J Vet Intern Med 2004; 18(3): 311-321.
[PubMed] - 7.
Keene BW, Atkins CE, Bonagura JD, et al. ACVIM consensus guidelines for the diagnosis and treatment of myxomatous mitral valve disease in dogs. J Vet Intern Med 2019; 33(3): 1127-1140.
[PubMed] - 8.
Vezzosi T, Grosso G, Tognetti R, et al. The Mitral Insufficiency Echocardiographic score: A severity classification of myxomatous mitral valve disease in dogs. J Vet Intern Med 2021; 35(3): 1238-1244.
[PubMed] - 9.
Rush JE: Cardiac emergencies. En Rozanski EA and Rush JE (ed): Small Animal Emergency and Critical Care Medicine: A Colour Handbook, London, Manson Publishing, 2007; 52-56
- 10.
Kirby R: Cardiovascular case 79. En Kirby R (ed): Self-assessment color review of small animal emergency & critical care medicine, London, Veterinary Press, 1998; 67-71.
- 11.
Ware WA: Intermittent Collapse and Syncope. En Ware WA and Bonagura JD (ed): Cardiovascular disease in companion animals dog, cat, and horse, Boca Raton, CRC Press, 2022; 195-199.
- 12.
2018 ACVIM Forum Research Abstract Program. Seattle, Washington, June 14 - 15, 2018. J Vet Intern Med 2018; 32(6): 2144-2309.
[PubMed] - 13.
Sadanaga KK, MacDonald MJ, Buchanan JW. Echocardiography and surgery in a dog with left atrial rupture and hemopericardium. J Vet Intern Med 1990; 4(4): 216-221.
[PubMed] - 14.
Yoshida T, Matsuura K, Chieh-Jen C, et al. Surgical treatment for left atrial rupture due to myxomatous mitral valve disease in three dogs: A case report. Vet Med Sci 2022; 8(6): 2261-2267.
[PubMed] - 15.
Sugiura H, Suzuki T, Mimura S, Kanemoto H. Retrospective evaluation of clinical signs, clinical course, and prognosis between dogs with left atrial rupture secondary to myxomatous mitral valve disease and those with neoplastic cardiac tamponade (2015-2019): 70 cases. J Vet Emerg Crit Care 2022; 32(6): 784-790.
[PubMed] - 16.
Research Communications of the 29th ECVIM-CA Congress. J Vet Intern Med 2020; 34(1): 339-530.
[PubMed]