Caso clínico de… Cirugía de tejidos blandos
N. Jurado, L. Fresno, L. Santos
Contacto: naiaraa.j@gmail.com
Historia clínica
Se presentó una border collie, hembra entera de 2 años de edad, 10 kg de peso, correctamente vacunada y desparasitada que solía tener un celo al año y convivía en un piso sin más animales. El motivo de consulta fueron episodios (cada 3-4 días) de sialorrea, ataxia y dolor abdominal, sobre todo después de las ingestas, desde hacía 2 años. Además, presentaba vómitos esporádicos y alternantes, sin patrón desde cachorra, así como poliuria y polidipsia. No tuvo acceso a tóxicos.
En el examen físico se realizó auscultación cardiaca y pulmonar, estado de hidratación, pulso femoral, frecuencia respiratoria, temperatura, palpación abdominal y valoración de condición corporal. Los hallazgos encontrados fueron condición corporal 3/6, taquipnea, sialorrea, temperatura 39,1 ºC (37,5-39,0 °C), dolor abdominal e inquietud marcada.
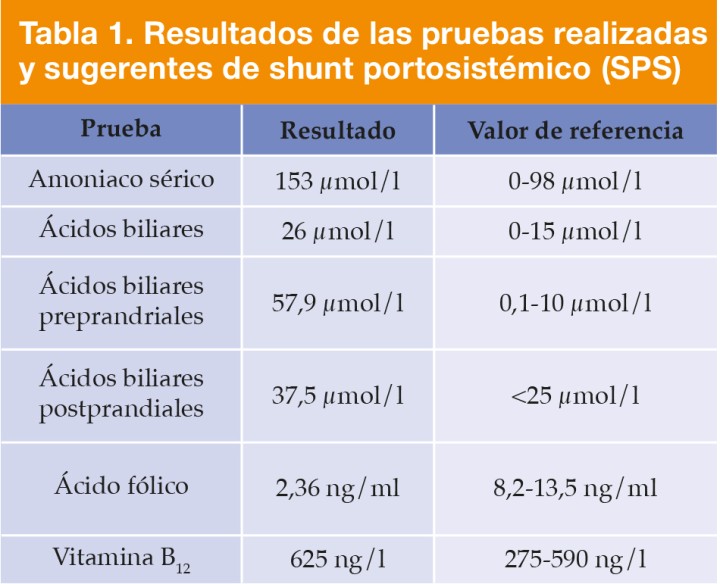
Dada la exploración física, se realizó una analítica completa donde se obtuvieron los resultados siguientes: linfopenia 0,21 x 103/µl (rango normal: 0,83-4,69) y monocitopenia 0,04 x 103/µl (rango normal: 0,14-1,97) a nivel de hemograma y en cuanto a la bioquímica, el único parámetro alterado fue la fosfatasa alcalina 283 UI/l (rango normal: 0-150). A nivel electrolítico, se observó hipokalemia 3,3 mEq/l (rango normal: 3,7-5,8).
¿Cuáles son los diagnósticos diferenciales más probables?
Entre los diagnósticos diferenciales que incluyen dolor abdominal en perros se encuentran pancreatitis, indiscriminación alimentaria, insuficiencia renal aguda, enteropatía y/o cuerpo extraño. Por otro lado, los diagnósticos diferenciales relacionados con la sialorrea y ataxia tras la ingesta incluyen intoxicación, hepatopatía, intolerancia alimentaria y/o shunt portosistémico.
¿Qué pruebas complementarias estarían indicadas para llegar a un diagnóstico definitivo?
En el presente caso se descartó un cuerpo extraño aparente y patrón obstructivo mediante radiografía abdominal, aunque se acabó de confirmar mediante una ecografía abdominal. La ecografía abdominal reveló renomegalia bilateral y microhepatía, cristales en vejiga urinaria y ausencia de cuerpo extraño. También eliminó la pancreatitis del diagnóstico diferencial, conjuntamente con el análisis de la TLI cuyo resultado resultó dentro del rango de la normalidad. A continuación, se analizó el ácido fólico y la vitamina B12, siendo los resultados 2,36 ng/ml (rango normal: 8,2-13 ng/ml) y 625 ng/l (rango normal: 275-590 ng/l), respectivamente, lo cual sugería una hepatopatía.1 Se prosiguió con la determinación de ácidos biliares séricos que resultaron elevados (26 µmol/l; rango normal: 0-15 µmol/l).
La paciente se quedó hospitalizada para estabilizarla y normalizar el potasio. El potasio se normalizó mediante su suplementación en suero fisiológico a 0,15 mEq/kg/h vía intravenosa (IV) y se realizaron controles cada 24 h con objeto de mantener el potasio en el rango de normalidad. La medicación intrahospitalaria fue la siguiente: maropitant (Prevomax®, Dechra, Bladel) 1 mg/kg IV, ácido fenoxi-2-metil-2 propiónico (Liverfine®, Fatro, Barcelona) 1 mg/kg IV y fluidoterapia con 50 ml/kg/día. Al día siguiente se realizó una ecografía abdominal donde se observaron cristales en la vejiga de la orina y renomegalia. Dados los hallazgos urinarios, se realizó una cistocentesis y un urianálisis completo. Los resultados del urianálisis revelaron un color ámbar oscuro, turbidez positiva, pH 6,5 (rango normal: 4,5-8,5), bilirrubina +3 (rango normal: negativo), hematíes negativo (rango normal: negativo), densidad urinaria 1,028 (rango normal: 1,015-1,045), cilindros negativo (rango normal: negativo), bacteriuria de >40 bacterias (rango normal: ausente), cristales de bilirrubina y urato amónico (rango normal: ausente). Tras recibir los resultados, se decidió realizar un test combinado de ácidos biliares, con un intervalo de 2 horas entre ambas tomas. El resultado para los ácidos prepandriales fue de 57,9 μmol/l (rango normal: 0,1-10 μmol/l) y para los postpandriales de 37,5 μmol/l (rango normal: <25 μmol/l), por lo que se consideró un resultado anómalo. Puesto que los resultados empezaban a ser concluyentes de shunt portosistémico (SPS), se realizó un test de amoniaco en sangre siendo el resultado 153 µmol/l (rango normal: 0-98 µmol/l). Estos hallazgos, conjuntamente con los de la Tabla 1, indicaban un posible shunt portosistémico.
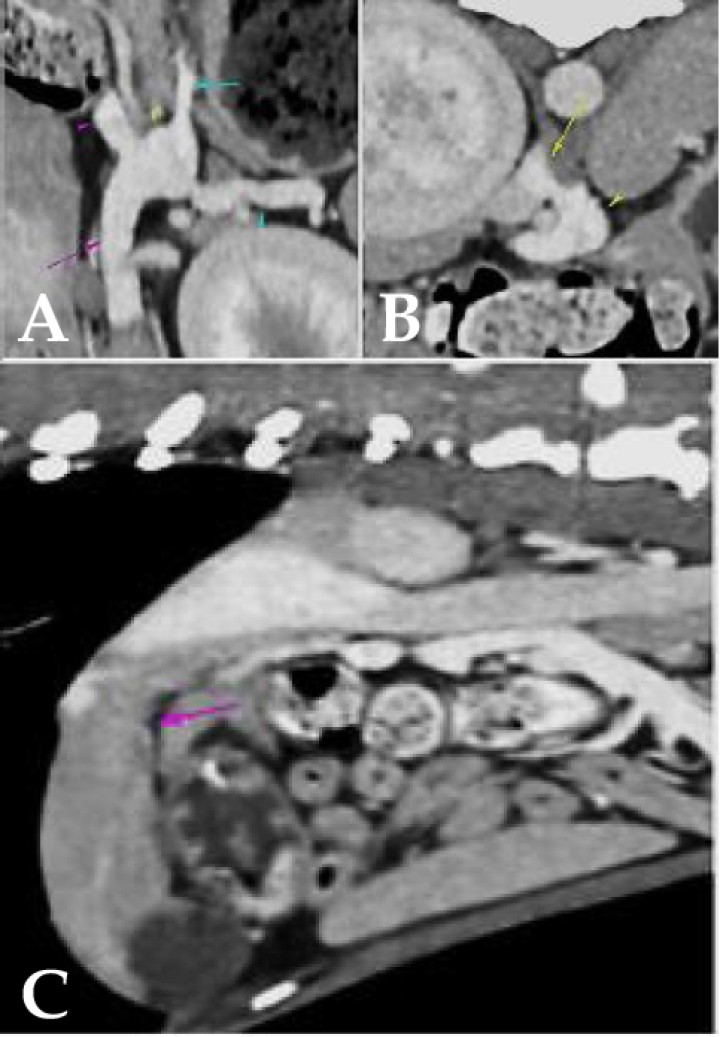
A continuación, se llevó a cabo una Tomografía Computarizada (TC) con contraste mediante una sedación con butorfanol 0,1 mg/kg IV (Torphadine, Dechra; Terrassa). Se decidió utilizar butorfanol, puesto que es un sedante leve que permitiría que la paciente no se moviese durante la realización de la TC con contraste, pues no interesaba una anestesia dado que en una paciente con probabilidad de shunt portosistémico, como bien se sospechaba, la anestesia podría resultar tediosa dada la disfuncionabiliad hepática. El informe de la TC reveló que la vena porta (Fig. 1A, flecha morada) presentaba un diámetro decreciente en sentido caudocraneal. Además, la vena gástrica izquierda (Fig. 1A, flecha azul) derivaba parcialmente en la vena esplénica (Fig. 1A, punta de flecha azul) y en un vaso anómalo que partía desde la vena esplénica, en la región comprendida entre la vena gástrica izquierda y la vena porta (Fig. 1B, punta de flecha amarilla), y que se dirigía craneodorsalmente a la vena cava caudal (Fig. 1B, flecha amarilla) en la que derivaba por el lado izquierdo, cranealmente a la arteria celíaca. El vaso anómalo medía aproximadamente 0,67 cm de diámetro.
Figura 1
Visualización de shunt portosistémico (SPS). (A) La vena porta (flecha rosa) presenta diámetro decreciente en sentido caudocraneal, midiendo 0,67 cm caudalmente a la recepción de la vena esplénica y 0,4 cm en el porta hepatis (punta de flecha rosa: vena porta cranealmente a la recepción de la vena esplénica). (A, B) La vena gástrica izquierda (flecha azul) deriva parcialmente en la vena esplénica (punta de flecha azul) y en un vaso anómalo que parte desde la vena esplénica, en la región comprendida entre la vena gástrica izquierda y la vena porta (punta de flecha amarilla), y se dirige craneodorsalmente a la vena cava caudal (flecha amarilla), en la que deriva por el lado izquierdo, cranealmente a la arteria celíaca. Este vaso anómalo mide aproximadamente 0,67 cm de diámetro) diagnosticado mediante TC con contraste. (C) Microhepatía (flecha morada) asociada a SPS mediante TC.
¿Qué tratamiento instaurarías?
Los propietarios, tras el diagnóstico, aceptaron realizar cirugía laparoscópica para tratar el shunt con una banda de celofán (Cellovet) (Fig. 2). Cabe mencionar que, antes de proceder al tratamiento definitivo, fue de vital importancia el tratamiento médico. El tratamiento médico pretende disminuir el transporte de tóxicos del tracto gastrointestinal a la circulación general y, así, minimizar los síntomas clínicos. Se recomienda, sobre todo a aquellos pacientes que vayan a ser sometidos a cirugía, estabilizarlos previamente y prolongarlo tras 1 mes postcirugía. Este tratamiento médico puede ser la única elección en perros donde exista imposibilidad de cirugía, bien sea por el poder adquisitivo del propietario o bien por la situación clínica en sí. El tratamiento se basa en la administración de lactulosa vía oral (VO), dieta hepática y neomicina durante 2 semanas previas a la cirugía. Cabe destacar como parte del tratamiento médico la utilización de levetiracetam en los casos más graves para el control de las convulsiones; en este caso no fue necesario. El protocolo anestésico elegido fue una premedicación con metadona 0,2 mg/kg intravenosa, la inducción con propofol a dosis efecto e intraquirúrgicamente se utilizó una infusión continua de remifentanilo a 0,4 µg /kg/min conjuntamente a isofluorano inhalatorio al 2 % (Isovet; Braun; Terrassa) y fluidoterapia a 5 ml/kg/h.
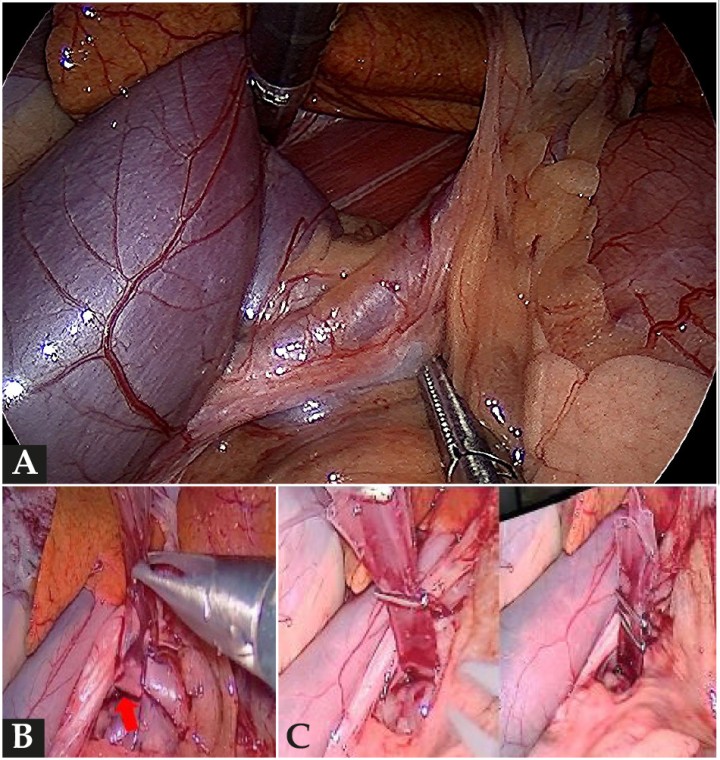
Figura 2
(A) Identificación y disección de SPS mediante laparoscopia. (B) Aislamiento de SPS mediante banda de celofán (flecha roja). (C) Cierre atenuado de SPS esplenocava mediante una banda de celofán con grapadora por laparoscopia.
El tratamiento quirúrgico se realizó mediante laparoscopia, con la utilización de tres trócares de 5 mm de diámetro. Una vez se identificó el shunt portosistémico esplenocava, se diseccionó para aislarlo y, a continuación, se procedió a una atenuación de la derivación mediante una banda de celofán, que fue sellada gracias a la utilización de una grapadora laparoscópica (Fig. 2). La banda de celofán genera un cierre paulatino de la derivación y evita así un aumento excesivo de la presión portal a consecuencia de un cierre completo directo. Sin embargo, podría provocar menor atenuación que las realizadas con anillo ameroide. Las intervenciones realizadas por laparoscopia parecen presentar una recuperación más rápida.2,3
La recuperación postquirúrgica no mostró signos de dolor, por lo que se decidió cambiar la analgesia de metadona por buprenorfina a 0,015 mg/kg IV cada 8 horas (Bupredine; Dechra; Terrassa). Se continuó con el tratamiento médico de soporte con lactulosa a 0,3-0,5 ml/kg PO (Duphalac; Abbot; Terrassa) cada 8 horas, dieta hepática y neomicina a 22 mg/kg PO cada 8 horas (Neomicina; Laboratorio Normon; Terrassa). La lactulosa se mantiene hasta 1 mes postcirugía siempre y cuando los signos clínicos hayan remitido. La dieta hepática se recomienda de por vida puesto que el hígado mantendrá cierta disfuncionalidad en comparación con otros perros que no hayan sufrido esta anomalía.10 La neomicina se recomienda administrar por un periodo de 7-10 días.3,5,6 Se decidió dar de alta 3 días postcirugía, puesto que la paciente presentaba las constantes dentro del rango de la normalidad, el dolor estaba controlado y toleraba la alimentación enteral.
La consulta de seguimiento fue al mes tras la cirugía y se observó que la paciente había ganado peso (16 kg). Además, la polidipsia había cesado, no había vuelto a tener ningún otro cuadro tras las ingestas, estaba mucho más activa y no había vuelto a vomitar. Dado que había una mejoría de los síntomas clínicos, se finalizaron las tomas de lactulosa al mes y medio de la operación, a diferencia de la dieta hepática que se mantuvo de por vida. El control de amoniaco sérico se llevó a cabo pasado un mes de la cirugía, así como los ácidos biliares, observándose que los valores de ambos se habían normalizado. Adicionalmente, se procedió a realizar una ecografía abdominal al mes de la cirugía donde se verificó el cierre paulatino del SPS mediante la medición del vaso anómalo y, posteriormente, se verificó el cierre completo a los 7 meses tras la cirugía.
Discusión
El shunt portosistémico (SPS) es una anomalía vascular hepática, congénita o adquirida. El diagnóstico se sospecha principalmente debido a la clínica del paciente y a las pruebas laboratoriales de ácidos biliares y amonio en sangre.7 No obstante, para obtener un diagnóstico definitivo se debe realizar ecografía abdominal y TC con contraste, aunque hay que tener en cuenta que la anestesia en estos pacientes debe ser mínima y cautelosa dada su insuficiencia hepática. Son interesantes los anestésicos de metabolismo extra hepático, pulmonar o renal. El tratamiento definitivo es quirúrgico.5 Aunque tanto la banda de celofán como el constrictor ameroide dan buenos resultados, proporcionando un cierre gradual de la comunicación entre la vena cava y la vena porta,4 el constrictor ameroide parecería superior en el cierre de shunts extrahepáticos.6 El cierre gradual evita un aumento excesivamente rápido de la presión portal, cuya presencia podría ser mortífera para el paciente.8 Desafortunadamente, no siempre se consigue un cierre completo de la derivación y queda un shunt persistente, pero sí puede haber resolución de los signos clínicos.8 Por otro lado, y no menos importante, el tratamiento médico es un gran apoyo tanto a nivel prequirúrgico como postquirúrgico.2 A nivel prequirúrgico utilizamos la lactulosa para inhibir el crecimiento de bacterias productoras de amoniaco, disminuir la absorción de amoniaco desde el intestino y promover el movimiento del contenido intestinal, disminuyendo la permeabilidad y mejorando la función de la barrera intestinal.8,9 También contribuye el uso de una dieta hepática para facilitar el metabolismo hepático y disminuir la concentración de proteína, así como un antibiótico para reducir la concentración de bacterias productoras de amoniaco. El mantenimiento del tratamiento médico postquirúrgico es importante, puesto que el cierre de la comunicación esplenocava es gradual y el paciente continuará teniendo deficiencias hepáticas y elevadas concentraciones de amonio hasta que el cierre sea completo, aunque en ocasiones queda un shunt residual. De hecho, según estudios, el 75 % de los perros necesitan continuar con el tratamiento médico.8 Pasado un mes postcirugía se debe repetir los análisis de ácidos biliares y amonio en sangre para corroborar que han disminuido. En general, el pronóstico es bueno a pesar de las complicaciones que se pueden presentar dependiendo de la edad del paciente y si hay o no hipertensión portal.10,11 Teniendo en cuenta diferentes pacientes con SPS, parece ser que la cirugía mediante laparoscopia, en comparación a la cirugía abierta, presenta un menor periodo de convalecencia y una recuperación temprana del paciente.
Fuente de financiación: este trabajo no se ha realizado con fondos comerciales, públicos o del sector privado.
Conflicto de interés: los autores declaran que no existe conflicto de intereses.
Bibliografía
- 1.
Muro N, Bujanda L, Sarasqueta C, et al. Niveles plasmáticos de la vitamina B12 y ácido fólico en pacientes con hepatopatía crónica. Gastroenterología y Hepatología 2010;33(4): 280-287.
[PubMed] - 2.
Mathews K; Bunch S. Hepatopatías vasculares. En: Ettinger, S; y Feldman E. Tratado de Medicina Interna veterinaria. Volumen 2. (6ª ed.) Madrid: Elsevier, pp. 1453-1464; 2007.
- 3.
Prades L. Manejo anestésico y quirúrgico del shunt portosistémico en la especie canina; Trabajo de fin de grado de la facultad de veterinaria de universidad de zaragoza; 2020; (4-12).
- 4.
Berent AC, Tobias KM. Cap 96. Hepatic vascular anomalies. In: KM Tobias, SA Johnston, eds. Veterinary Surgery: Small Animal. Vol 2. 2nd ed. St. Louis, MO; 2018.
- 5.
Greenhalgh SN, Dunning MD, McKinley TJ, et al. Comparison of survival after surgical or medical treatment in dogs with a congenital portosystemic shunt. J Am Vet Med Assoc 2010; 236(11): 1215-1220.
[PubMed] - 6.
Serrano G, Charalambous M, Devriendt N, et al. Treatment of congenital extrahepatic portosystemic shunts in dogs: A systematic review and meta-analysis. J Vet Intern Med 2019; 33(5): 1865-1879.
[PubMed] - 7.
Aranda FY, Rico S. Manejo quirúrgico del shunt portosistémico extrahepático congénito en el perro; Axoncomunicacion.net 2021.
- 8.
Poggi E, Rubio DG, Pérez Duarte FJ, Del Sol JG, Borghetti L, Izzo F, Cinti F. Laparoscopic portosystemic shunt attenuation in 20 dogs (2018-2021). Vet Surg 2022; 51 Suppl 1:O138-O149.
[PubMed] - 9.
M.P. Xifra, Y. Espada, S.I. Serrano, E. Rollán, M.R. Broome, M.E. Peterson. Clinical applications of scintigraphy in small animals. Revista oficial de la Asociación Veterinaria Española de Especialistas en Pequeños Animales, AVEPA 2019; 39(2):71-8.
- 10.
Joffe MR, Hall E, Tan C, Brunel L. Evaluation of different methods of securing cellophane bands for portosystemic shunt attenuation. Vet Surg 2018; 48(1): 42-49.
[PubMed] - 11.
Montesinos Durà D, Serrano Casorrán C, Gonzalo O, Luis Á, Martínez Sañudo MJ. El shunt portosistémico en la especie canina. Revisión de la casuística durante un año en el hospital veterinario de la Universidad de Zaragoza. zaguan-unizar.es 2015.