Estudio retrospectivo (2018-2022) de la prevalencia de Staphylococcus pseudintermedius resistentes a meticilina y multirresistentes, implicados en piodermas caninas en un centro dermatológico en Madrid (España)
Retrospective study (2018-2022) on the prevalence of methicillin-resistant and multi-drug-resistant Staphylococcus pseudintermedius involved in canine pyoderma at a dermatology center in Madrid (Spain)
C. Yotti-Álvarez, J. Pérez-Gaviro, M. Pérez-Aranda-Redondo
Contacto: cesaryotti@gmail.com
Resumen
La resistencia a los antibióticos está aumentando en medicina humana y veterinaria. El objetivo principal de este estudio era explorar la prevalencia de infecciones cutáneas producidas por bacterias Staphylococcus pseudintermedius resistentes a meticilina (SPRM) y multirresistentes (MDR) en perros, en un centro veterinario especializado en dermatología en España, durante 2018-2022, y evaluar la administración de antibioterapia en el último año como posible factor de riesgo. Se seleccionaron 119 pacientes caninos con diagnóstico de pioderma superficial o profunda y aislamiento bacteriano de Staphylococcus pseudintermedius (SP). Se registraron variables como edad, sexo, raza, tipo y distribución de lesiones, exposición a antibioterapia y método de toma de muestra. El 41 % (49/119) se identificó como SPRM y el 58,8 % (70/119) como MDR. El 87 % de los SP fueron resistentes a macrólidos, siendo el grupo de antibióticos frente al que más SP presentaban resistencias. La exposición a antibióticos en el último año se identificó como un factor de riesgo significativo para infecciones por SPRM y MDR. En conclusión, se encontró un porcentaje muy elevado de aislamientos de SPRM y MDR, destacando la exposición a antibioterapia como un factor de riesgo notable, lo que subraya la importancia de racionalizar el uso de antibióticos en medicina veterinaria.
Palabras clave: pioderma canina, Staphylococcus pseudintermedius, resistencia a meticilina, multirresistencia.
Clin Vet Peq Anim 2024, 44 (3): 173-179
Summary
Antibiotic resistance is increasing in both human and veterinary medicine. The main objective of this study was to explore the prevalence of skin infections caused by methicillin-resistant Staphylococcus pseudintermedius (MRSP) and multi-resistant (MDR) bacteria in dogs at a veterinary dermatology center in Spain from 2018 to 2022, and to evaluate the administration of antibiotic therapy in the past year as a possible risk factor. A total of 119 canine patients diagnosed with superficial or deep pyoderma and bacterial isolation of Staphylococcus pseudintermedius (SP) were selected. Variables such as age, sex, breed, type and distribution of lesions, exposure to antibiotic therapy, and sampling method were recorded. Of these, 41% (49/119) were identified as MRSP and 58.8% (70/119) as MDR. Additionally, 87% of SP isolates were resistant to macrolides, making this the antibiotic group with the highest resistance. Exposure to antibiotics in the past year was identified as a significant risk factor for developing MRSP and MDR infections. In conclusion, a high percentage of MRSP and MDR infections were found, highlighting recent antibiotic exposure as a notable risk factor. This emphasizes the importance of rationalizing the use of antibiotics in veterinary medicine.
Keywords: canine pyoderma, Staphylococcus pseudintermedius, methicillin resistance, multiresistance.
Clin Vet Peq Anim 2024, 44 (3): 173-179

La presencia de este logo en un artículo de la revista indica que se publicará un examen sobre el mismo en la plataforma AVEPA Elearning. Su resolución aporta 0,15 créditos dentro del sistema de acreditaciones de especialidades veterinarias de AVEPA.
Introducción
Staphylococcus pseudintermedius (SP) es una bacteria de morfología cocoide, Gram-positiva y coagulasa positiva, que conforma colonias de mediano tamaño, no pigmentadas.1 Se considera una bacteria comensal, tanto en la piel como en las membranas mucosas, de la especie canina. Es el microorganismo implicado en la inmensa mayoría de los casos de infecciones cutáneas caninas, tanto superficiales como profundas, por lo que su importancia en el área de la dermatología veterinaria es capital.2
Su patogenicidad se ha considerado tradicionalmente escasa y de carácter oportunista, produciendo infecciones cutáneas más frecuentemente en individuos inmunosuprimidos o con enfermedades concomitantes, como aquellas autoinmunes o la dermatitis atópica canina (DAC).1 No obstante, nuevos hallazgos podrían hacer necesario reconsiderar esta aseveración, ya que se ha puesto de manifiesto la existencia de cepas de SP cuya patogenicidad y virulencia es sensiblemente superior a la media observada hasta el momento.3,4
La resistencia antimicrobiana es un fenómeno en expansión, reconocido en todas las áreas de la medicina en la actualidad, que impacta de modo directo en el enfoque y manejo terapéutico en medicina veterinaria.2,5
Las cepas de Staphylococcus aureus resistentes a meticilina (SARM), identificadas por su resistencia al antibiótico oxacilina, son resistentes a todos los antibióticos del grupo de los β-lactámicos, lo cual supone un serio problema en medicina humana. El mecanismo de resistencia de S. aureus a la meticilina se basa en la síntesis de la proteína transpeptidasa PBP2a o PBP2´, la cual exhibe poca afinidad por la meticilina y otros β-lactámicos. El elemento genético cromosómico responsable de la resistencia es el gen mecA, incluido en la isla genómica SCCmec (Cromosoma Cassete Estafilocócico mec), un elemento genético móvil.6 Aunque este es el mecanismo de resistencia a la meticilina más importante, es preciso destacar que no es el único, ya que existen cepas de Staphylococcus spp resistentes a meticilina donde están implicados diversos y complejos mecanismos como la hiperproducción de β-lactamasas o la alteración de proteínas PBPs 1, 3 y 4.6
En medicina veterinaria, el desarrollo de cepas de SP multirresistentes (MDR por sus siglas en inglés), entendiendo como tal la resistencia a algún integrante de más de tres grupos de antibióticos diferentes,7 constituye un reto terapéutico y un riesgo potencial de salud pública en nuestros días. La posibilidad de que una cepa SPRM adquiera posteriormente características de multirresistencia es muy elevada, debido a que la mutación en el gen mecA abre la puerta al desarrollo de nuevas resistencias, especialmente a lincosamidas y fluoquinolónicos.6
En el campo de la medicina veterinaria y, en concreto, en el área de la dermatología de pequeños animales existen indicios de un posible incremento de las tasas de resistencia a meticilina en cepas de SP, así como de la incidencia de infecciones cutáneas en la especie canina por SPRM en España.8,9
No obstante, se aprecian grandes diferencias entre los distintos estudios publicados hasta la fecha, las cuales podrían ser atribuibles a particularidades geográficas o de manejo clínico, especialmente en cuanto a la frecuencia de administración de antibioterapia de modo profiláctico o terapéutico recurrente.2,5
Uno de los principales factores que han sido demostrados en medicina humana como predisponentes para la selección y el desarrollo de cepas bacterianas multirresistentes es el abuso de la terapia antibiótica o su empleo reiterado, especialmente cuando este incluye la administración de fluoquinolónicos o cefalosporinas de 3ª generación.10 En medicina veterinaria existen muy pocos estudios al respecto, aunque todo parece indicar que podría existir una marcada analogía con lo observado en medicina humana.11
Los principales objetivos de este estudio fueron (i) explorar la prevalencia de infecciones cutáneas producidas por SPRM y MDR en la especie canina en el periodo estudiado, así como (ii) identificar si la administración de antibioterapia en el último año podría considerarse como un factor de riesgo en el desarrollo de infecciones cutáneas por bacterias SPRM y MDR en la especie canina.
Material y métodos
Se realizó un estudio retrospectivo para el cual se analizaron los historiales clínicos de los pacientes caninos que fueron atendidos por cuadros de infecciones cutáneas superficiales o profundas en el Centro Dermatológico Veterinario Medivet Skinpet, en Madrid (España), durante el periodo comprendido entre el 1 de enero de 2018 y el 31 de diciembre de 2022. Este centro está dedicado en exclusiva al campo de la dermatología y atiende en su mayoría casos referidos o de especial complejidad. Se consideraron como criterios de inclusión aquellos pacientes caninos en los que:
⁻ se hubiera realizado el diagnóstico clínico y citológico de pioderma superficial o profunda;
⁻ se hubiera realizado un cultivo bacteriano mediante hisopado o biopsia cutánea;
⁻ se hubiera obtenido el aislamiento del agente infeccioso SP, en aislamiento puro o mixto.
Las clases de antibióticos testados en el antibiograma para las muestras obtenidas mediante hisopado fueron: β-lactámicos (benzilpenicilina, oxacilina, ampicilina, amoxicilina/clavulánico, cefalexina, cefalotina, cefpodoxima, cefovecina), fluoroquinolónicos (enrofloxacina, marbofloxacina, pradofloxacina), aminoglucósidos (amikacina, gentamicina), lincosamidas (clindamicina), macrólidos (eritromicina), sulfamidas (trimetoprim/sulfametoxazol), tetraciclinas (doxiciclina, minociclina), fenicoles (cloranfenicol) y rifampicina, estos dos últimos en casos puntuales.
Las clases de antibióticos testados en el antibiograma para las muestras obtenidas por biopsia fueron: β-lactámicos (oxacilina), fluoroquinolónicos (ciprofloxacina, marbofloxacina, pradofloxacina), aminoglucósidos (gentamicina, amikacina), lincosamidas (clindamicina), macrólidos (eritromicina), sulfamidas (trimetoprim/sulfametoxazol), tetraciclinas (tetraciclina, doxiciclina y minociclina) y rifampicina.
Los microorganismos aislados se clasificaron como resistentes (R), sensibles (S) o intermedios (I) según el sistema automatizado VITEK2® (bioMérieux® Francia), estandarizados para el estudio de concentración mínima inhibitoria (CMI) según las guías clínicas del Clinical and Laboratory Standard Institute (CLSI), o como resistentes (R) o sensibles (S) según la técnica de discos de difusión en agar (Kirby-Bauer). Las muestras obtenidas mediante hisopado se enviaron al laboratorio Idexx® Laboratories España, mientras que las muestras obtenidas por biopsia se enviaron al laboratorio Leti Pharma®.
Como indicador de resistencia a la meticilina se empleó el antibiótico oxacilina (OXA), y se clasificó la cepa como multirresistente cuando se constató la resistencia adquirida al menos a un agente antibiótico en más de tres clases de antibióticos diferentes.
Se realizó un análisis descriptivo de las variables que incluyeron las edades medias de los pacientes estudiados y la frecuencia de las razas más representadas en la muestra. Se calcularon los porcentajes de resistencia a los diferentes grupos de antibióticos testados, así como la frecuencia de los microorganismos aislados resistentes a OXA y multirresistentes.
El estudio estadístico realizado incluyó un análisis de asociación mediante X2 de Pearson entre las variables frecuencia de aislamiento de SPRM/MDR y tipo lesional, método de recogida de la muestra y administración de antibioterapia en el último año. Seguidamente se realizó el cálculo del Odds Ratio (OR) para las variables que mostraron asociación, con el fin de identificar posibles factores de riesgo. Para el estudio estadístico se empleó el programa informático JASP® y software Medcalc®. Se estableció una p<0,05 como nivel de significación estadística.
Resultados
Se identificaron 211 pacientes caninos con infección cutánea en los que se había realizado un cultivo bacteriológico en el periodo estudiado. De estos se seleccionaron 119 para el estudio y se excluyeron 92, en los que se habían aislado elementos infecciosos diferentes de SP.
De los 119 pacientes objeto de estudio se recogieron los siguientes datos: raza, sexo, edad, tipo de lesión, localización anatómica, exposición a antibioterapia en el último año y método de toma de muestra para el cultivo.
Variables sexo, edad y raza
De los 119 pacientes seleccionados el 56 % eran machos y el 44 % hembras, con una mediana de edad de 7 años (rango 1,5-14 años). En la muestra estudiada la mayoría de los pacientes fueron de raza pura (87 %), frente a tan solo un 13 % de mestizos. Las razas representadas con mayor frecuencia en el estudio fueron el labrador retriever (n=14), bull terrier (n=13), american staffordshire terrier (n=11) y west highland white terrier (n=11).
Método de toma de muestras, tipo lesional y localización anatómica
Las muestras para cultivo se obtuvieron mediante hisopado en la gran mayoría de las muestras (n=93), parte de las cuales (n=42) se tomaron de lesiones pápulo-pustulares en casos de pioderma superficial, obteniéndose el resto (n=51) de lesiones nodulares-fistulosas o ulcerativas en casos de pioderma profunda. Las muestras recogidas mediante cultivo de tejido cutáneo obtenido por biopsia fueron en todos los casos procedentes de lesiones de pioderma profunda de especial gravedad o falta de respuesta a tratamientos antibióticos basados en cultivos superficiales (n=26)
Las áreas anatómicas más frecuentemente afectadas fueron la región del tronco (46 %), región carpal y tarsal (23 %) e interdigital (19 %).
Perfil de resistencia a antibióticos
Dentro del total de las muestras analizadas el 41 % (49/119) mostraron resistencia a la oxacilina, clasificándose por tanto como SPRM.
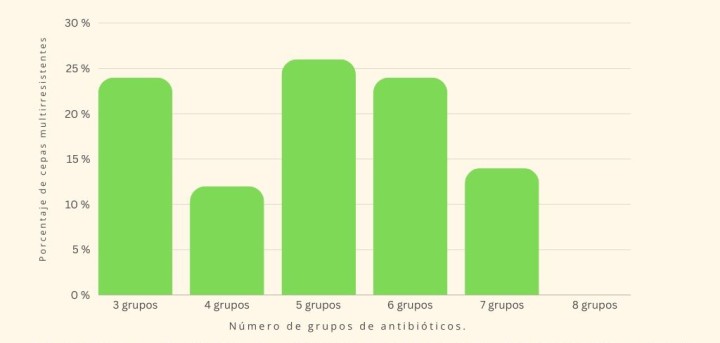
Por otra parte, un 58,8 % (70/119) mostraron características de multirresistencia, considerándose como tal las cepas de SP resistentes a más de tres antibióticos pertenecientes a tres grupos diferentes, con una resistencia media a 5 grupos de antibióticos diferentes (rango 3-7) (Fig. 1). Los aislados que podrían considerarse como “extensive drug resistant” (o, por sus siglas en inglés, XDR, resistentes a 7 grupos de antibióticos diferentes) fueron el 14 % de los aislados MDR (10/70), no observándose ninguna cepa de SP “pandrug resistant” (o PDR, resistente a todos los grupos de antibióticos testados).
Figura 1
Porcentaje de cepas de Staphylococcus pseudintermedius multirresistentes en función del número de grupos de antibióticos a los que muestran resistencia.
En el modelo final, se aislaron más cepas de SPRM/MDR en muestras tomadas por biopsia que en las recogidas mediante hisopo, con una diferencia estadísticamente significativa (p=0,0004; OR: 5,7; IC 95 %: 2,16-15,02).
Ni la localización anatómica ni el tipo de lesión predominante mostraron asociación con el desarrollo de infecciones por SPMR o MDR (p >0,05).
Se estableció una fuerte relación positiva entre la exposición a antibioterapia en el último año y la posibilidad de que la cepa de S. pseudintermedius aislada en casos de infección cutánea canina fuera SPRM (p=0,008; OR: 45,9; IC 95 %: 22,70-778,5) o MDR (p=0,0002; OR: 47,58; IC 95%: 6,09-371,38).
No se observó ninguna cepa con resistencia a OXA sin características concomitantes de multirresistencia, pero sí cepas MDR sensibles a OXA. Estas cepas mostraron resistencia a los siguientes antibióticos por orden de frecuencia: macrólidos, lincosamidas, tetraciclinas y sulfamidas.
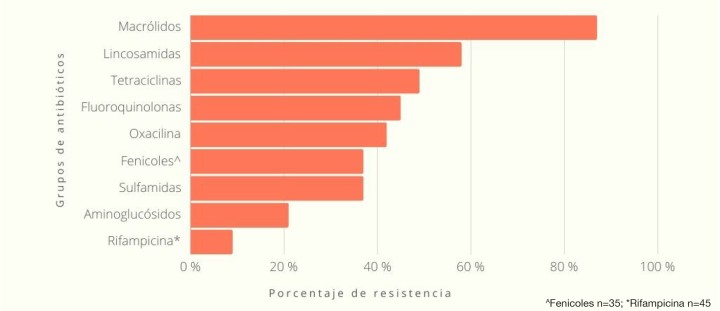
El grupo antibiótico al que las cepas aisladas mostraron un mayor porcentaje de resistencia fue el de los macrólidos con un 87 % de muestras resistentes a la eritromicina, seguido de las lincosamidas con un 58 % de resistentes a clindamicina. En el extremo opuesto se situaron los aminoglucósidos con un 21 % de cepas resistentes a la gentamicina y un 1,8 % a la amikacina. La rifampicina mostró un 9 % de aislados resistentes en las 45 muestras en las que se obtuvo este dato (Fig. 2). La resistencia a tetraciclinas y fluoroquinolónicos se situó en un 49 % y 45 %, respectivamente. La resistencia a sulfamidas fue del 37 % en consonancia con la obtenida para el grupo de los fenicoles, si bien es importante destacar que este último grupo de antibióticos únicamente fue testado sobre 35 muestras (Fig. 2).
Figura 2
Porcentaje de resistencia de los aislados de Staphylococcus pseudintermedius (n=119) frente a los distintos grupos de antibióticos testados.
Discusión
La resistencia antibiótica es un fenómeno en clara expansión a nivel mundial en medicina humana y veterinaria, dentro del concepto “One Health”,5 lo cual pone el foco sobre preocupantes consideraciones de salud pública.12-13En dermatología veterinaria la bacteria procedente de procesos infecciosos aislada con mayor frecuencia es el SP, cuya virulencia3 y perfil de resistencia a los antibióticos están sufriendo cambios relevantes.8,9
Nuestro estudio revela hallazgos significativos sobre la resistencia antibiótica en cepas de SP. El 41 % del total de muestras analizadas (49/119) muestra resistencia a la OXA, y el 58,8 % (70/119) de cepas de SP analizadas presenta características de multirresistencia. Observamos una correlación entre la resistencia a OXA y la multirresistencia. Estudios similares han obtenido valores dispares dependiendo de la región geográfica y las características de la población analizada.2
En otros estudios la variabilidad de los resultados obtenidos en cuanto a porcentaje de cepas SPRM es considerable, situándose en un intervalo del 0,7 %14 al 56,2 %,15 con unos valores medios de un 30,10 %. Nuestros resultados, con el 41 % de SPRM, se sitúan en el rango alto de esta horquilla, en consonancia con otros estudios análogos en cuanto a origen de las muestras y tipo de centro veterinario de referencia u hospitalario.16-20
Respecto al aislamiento de cepas MDR y con los mismos criterios de clasificación empleados en nuestro estudio,7 los resultados obtenidos se sitúan entre el 31,6 %21y el 87 %,8 con un valor medio del 58,17 %. Nuestros resultados con un 58,8 % de aislados MDR se sitúan en la media y coinciden con estudios de similares características realizados en España8 o EE. UU.15
En un estudio retrospectivo (2007-2016) realizado en la Universidad Complutense de Madrid (UCM)8 sobre los perfiles de resistencia antibiótica en Staphylococcus coagulasa positivos (SCoP), con muestras procedentes en su mayoría de la especie canina, se observó un 16 % de cepas SPMR, un valor muy alejado del 41 % de nuestro estudio, mientras que las cepas MDR se situaron en un 47,48 %, un porcentaje próximo a nuestro resultado del 58,8 %. Más recientemente, un estudio realizado en Valencia en perros y gatos, tanto asintomáticos (77 %) como con patología cutánea crónica (23 %), determinó una prevalencia de Staphylococcus spp resistentes a meticilina del 30 % y MDR del 70 % en el perro.9
Los antibióticos a los que los aislados de SP de nuestra muestra mostraron un mayor nivel de resistencia fueron los macrólidos con un 87 %, seguidos de las lincosamidas con un 58 % y las tetraciclinas con un 49 %, cifras muy elevadas en comparación con estudios análogos.8,9,15,19,22 La resistencia observada frente a fluoroquinolónicos fue del 45 %, muy por encima de los valores recogidos en estudios similares en España, que la sitúan entre un 22 %8 y un 26,4 %,9,22 y Portugal (25,2 %),23 alineándose más con estudios publicados en EE. UU. que indican una tendencia creciente de la resistencia a fluoroquinolónicos en cepas de SP aisladas de pacientes caninos con piodermas recidivantes o crónicas.16 El 37 % de los SP mostraron resistencia a las sulfamidas. En el extremo opuesto se sitúa la rifampicina con un 9 % de cepas SP resistentes en las muestras estudiadas, aunque no pudo ser testado en la totalidad de los casos, ya que, dadas las particularidades de este fármaco, se testó solo en casos excepcionales o de especial gravedad. Estos resultados coinciden con estudios previos análogos.24 Es importante destacar que la rifampicina es un antibiótico englobado en la clase A según la categorización de las clases de antibiótico de uso veterinario de la Agencia Europea del Medicamento (EMA). Se trata de un fármaco no autorizado como medicamento veterinario en la UE, estando prohibido su empleo en animales de producción y pudiendo emplearse solo bajo condiciones justificadas y de carácter excepcional en pequeños animales.
Se identificó un nivel de resistencia a los aminoglucósidos del 21 % en las muestras estudiadas, centrándonos específicamente en la gentamicina, aunque es preciso especificar que la amikacina fue el antibiótico que mostró los niveles de resistencia más reducidos frente a cepas de SP de nuestro estudio, con solo un 1,8 % de cepas resistentes. Estos resultados, en línea con publicaciones anteriores,15,19,21-22 sitúan a la amikacina como un antibiótico potencialmente eficaz en el manejo terapéutico de pacientes caninos con infecciones cutáneas por bacterias SPRM-MDR.25 Sin embargo, es importante considerar que la amikacina se encuentra englobada dentro de la clase C según la EMA, por lo que siempre debería ser empleada con precaución y en ausencia de otra opción terapéutica englobada en el grupo D. Es, además, de vital importancia calcular cuidadosamente el ratio riesgo-beneficio antes de considerar esta opción, habida cuenta de los conocidos y graves efectos secundarios potenciales, especialmente a nivel renal y vestíbulo-coclear, tras su empleo en tratamientos prolongados.26
La toma de biopsias cutáneas se realizó solo en pacientes con pioderma profunda de larga duración o especial gravedad, o donde los cultivos previos con hisopado no identificaron el agente infeccioso. Los resultados obtenidos, que muestran un mayor porcentaje de cepas resistentes a la meticilina (SPMR) y multirresistentes (MDR), podrían deberse a un sesgo de selección. Sería útil un estudio comparativo entre métodos de toma de muestras (hisopado y biopsia) para medir la eficacia diagnóstica en infecciones cutáneas profundas por Staphylococcus pseudintermedius (SP).
El factor de riesgo principal para la identificación de cepas SPMR o MDR en pacientes con pioderma canina fue la exposición reciente a antibioterapia en el último año. Nuestros hallazgos concuerdan con estudios similares que señalan la antibioterapia previa como un factor de riesgo para desarrollar infecciones cutáneas caninas por SPMR-MDR.10,27-29 Hubiera sido ideal especificar los antibióticos administrados, las dosis, la duración de los tratamientos y otros factores de riesgo como hospitalizaciones, cirugías previas o terapias inmunosupresoras, para obtener conclusiones más precisas. Sin embargo, la naturaleza retrospectiva del estudio y la falta de informes clínicos detallados limitaron el acceso a esta información.
Otra limitación es la heterogeneidad de las muestras provenientes de casos de pioderma superficial y profunda, atendidos en un centro veterinario especializado o de tercer nivel. Esto podría haber sobrerrepresentado la presencia de infecciones por SPMR o MDR en comparación con la población general, dado el curso crónico y recidivante de las infecciones cutáneas en nuestros pacientes, muchos de los cuales también padecen dermatitis atópica canina. Es común que estos pacientes hayan recibido terapias inmunosupresoras y antibioterapia prolongada, lo cual puede ejercer una presión selectiva positiva sobre cepas de SP resistentes a la meticilina y/o multirresistentes. No obstante, un estudio en EE. UU.17 comparó los niveles de SPMR en pacientes de un centro de referencia y un centro generalista, encontrando que solo la terapia antibiótica previa era un factor de riesgo significativo para el aislamiento de bacterias SPMR en ambos grupos.
El sistema VITEK2 utilizado para la identificación bacteriana podría ser una limitación, ya que estudios comparativos con PCR y MALDI-TOF muestran diferencias significativas, siendo estos últimos más fiables.18,22
Finalmente, la resistencia a la oxacilina (OXA) como método de identificación de cepas de SP resistentes a la meticilina utilizó dos métodos diferentes (Kirby-Bauer y microdilución), lo que podría distorsionar los resultados. Complementar con la identificación del gen mecA y el cassete cromosómico estafilocócico (SCCmec) hubiera podido aumentar la fiabilidad, aunque existe una correlación muy elevada entre la resistencia a OXA y la identificación del gen mecA en la mayoría de las cepas de SP estudiadas.18
En conclusión, y a pesar de las limitaciones previamente descritas, este estudio constata la existencia de una elevada prevalencia de SPMR y/o MDR en cultivos bacterianos de pacientes con pioderma canina en un centro veterinario de referencia en España, identificando la administración de antibioterapia reciente como un factor de riesgo crítico. Se necesitan estudios más amplios y medidas correctivas urgentes para el uso de antibioterapia en la práctica veterinaria.
Fuente de financiación: el autor declara que no ha recibido fuente de financiación para la realización del estudio y no presenta ningún conflicto de interés.
Conflicto de intereses: el autor declara que no presenta ningún conflicto de interés.
Bibliografía
- 1.
Bannoehr J, Guardabassi L. Staphylococcus pseudintermedius in the dog: taxonomy, diagnostics, ecology, epidemiology and pathogenicity. Vet Dermatol 2012; 23(4): 253-266, e51-52.
[PubMed] - 2.
Morris DO, Loeffler A, Davis MF, Guardabassi L, Weese JS. Recommendations for approaches to meticillin-resistant staphylococcal infections of small animals: diagnosis, therapeutic considerations and preventative measures. Vet Dermatol. 2017; 28(3): 304-e69.
[PubMed] - 3.
Breyer GM, Saggin BF, de Carli S, et al. Virulent potential of methicillin-resistant and methicillin-susceptible Staphylococcus pseudintermedius in dogs. Acta Trop 2023; 242: 106911.
[PubMed] - 4.
Ferrer L, García-Fonticoba R, Pérez D, Viñes J, et al. Whole genome sequencing and de novo assembly of Staphylococcus pseudintermedius: a pangenome approach to unravelling pathogenesis of canine pyoderma. Vet Dermatol 2021; 32(6): 654-663.
[PubMed] - 5.
Walther B, Tedin K, Lübke-Becker A. Multidrug-resistant opportunistic pathogens challenging veterinary infection control. Vet Microbiol 2017; 200: 71-78.
[PubMed] - 6.
Peacock SJ, Paterson GK. Mechanisms of Methicillin Resistance in Staphylococcus aureus. Annu Rev Biochem 2015; 84: 577-601.
[PubMed] - 7.
Magiorakos AP, Srinivasan A, Carey RB, et al. Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: an international expert proposal for interim standard definitions for acquired resistance. Clin Microbiol Infect Off Publ Eur Soc Clin Microbiol Infect Dis 2012; 18(3): 268-281.
[PubMed] - 8.
Pérez-Sancho M, Alvarez-Perez S, Garcia-Seco T, et al. Antimicrobial Resistance of Coagulase-Positive Staphylococcus Isolates Recovered in a Veterinary University Hospital. Antibiotics 2020; 9(11): 752.
[PubMed] - 9.
Marco-Fuertes A, Marin C, Gimeno-Cardona C, et al. Multidrug-Resistant Commensal and Infection-Causing Staphylococcus spp. Isolated from Companion Animals in the Valencia Region. Vet Sci 2024; 11(2): 54.
[PubMed] - 10.
Bell BG, Schellevis F, Stobberingh E, Goossens H, Pringle M. A systematic review and meta-analysis of the effects of antibiotic consumption on antibiotic resistance. BMC Infect Dis 2014; 14: 13.
[PubMed] - 11.
Zur G, Gurevich B, Elad D. Prior antimicrobial use as a risk factor for resistance in selected Staphylococcus pseudintermedius isolates from the skin and ears of dogs. Vet Dermatol 2016; 27(6): 468-e125.
[PubMed] - 12.
Carroll KC, Burnham CAD, Westblade LF. From canines to humans: Clinical importance of Staphylococcus pseudintermedius. PLoS Pathog 2021; 17(12): e1009961.
[PubMed] - 13.
Guimarães L, Teixeira IM, da Silva IT, et al. Epidemiologic case investigation on the zoonotic transmission of Methicillin-resistant Staphylococcus pseudintermedius among dogs and their owners. J Infect Public Health 2023; 16 (Suppl 1): 183-189.
[PubMed] - 14.
Miszczak M, Korzeniowska-Kowal A, Wzorek A, et al. Colonization of methicillin-resistant Staphylococcus species in healthy and sick pets: prevalence and risk factors. BMC Vet Res 2023; 19(1): 85.
[PubMed] - 15.
Beever L, Bond R, Graham PA, et al. Increasing antimicrobial resistance in clinical isolates of Staphylococcus intermedius group bacteria and emergence of MRSP in the UK. Vet Rec 2015; 176(7): 172-172.
[PubMed] - 16.
Burke M, Santoro D. Prevalence of multidrug-resistant coagulase-positive staphylococci in canine and feline dermatological patients over a 10-year period: a retrospective study. Microbiology 2023; 169(2): 001300.
[PubMed] - 17.
Eckholm NG, Outerbridge CA, White SD, Sykes JE. Prevalence of and risk factors for isolation of meticillin-resistant Staphylococcus spp. from dogs with pyoderma in northern California, USA. Vet Dermatol 2013; 24(1): 154-e34.
[PubMed] - 18.
Nisa S, Bercker C, Midwinter AC, et al. Combining MALDI-TOF and genomics in the study of methicillin resistant and multidrug resistant Staphylococcus pseudintermedius in New Zealand. Sci Rep 2019; 9(1): 1271.
[PubMed] - 19.
Escribano. Patrones de sensibilidad de Staphylococcus pseudintermedius aislados de infecciones cutáneas en el perro [Internet]. Axon Comunicación. Expertos en soluciones integrales. 2020 [citado 3 de enero de 2024]. Disponible en: https://axoncomunicacion.net/patrones-de-sensibilidad-de-staphylococcus-pseudintermedius-aislados-de-infecciones-cutaneas-en-el-perro/
- 20.
Lord J, Millis N, Jones RD, et al. Patterns of antimicrobial, multidrug and methicillin resistance among Staphylococcus spp. isolated from canine specimens submitted to a diagnostic laboratory in Tennessee, USA: a descriptive study. BMC Vet Res 2022; 18(1): 91.
[PubMed] - 21.
Menandro ML, Dotto G, Mondin A, et al. Prevalence and characterization of methicillin-resistant Staphylococcus pseudintermedius from symptomatic companion animals in Northern Italy: Clonal diversity and novel sequence types. Comp Immunol Microbiol Infect Dis 2019; 66: 101331.
[PubMed] - 22.
Pérez-Sancho M, Alvarez-Perez S, Garcia-Seco T, et al. Antimicrobial Resistance of Coagulase-Positive Staphylococcus Isolates Recovered in a Veterinary University Hospital. Antibiotics 2020; 9(11): 752.
[PubMed] - 23.
Morais C, Costa SS, Leal M, et al. Genetic diversity and antimicrobial resistance profiles of Staphylococcus pseudintermedius associated with skin and soft-tissue infections in companion animals in Lisbon, Portugal. Front Microbiol [Internet]. 2023 [citado 2 de enero de 2024];14. Disponible en: https://www.frontiersin.org/articles/10.3389/fmicb.2023.1167834
[PubMed] - 24.
Harbour L, Schick A, Mount R, White A. Rifampicin treatment of canine multidrug-resistant meticillin-resistant staphylococcal pyoderma: A retrospective study of 51 cases. Vet Dermatol 2022; 33(5): 384-391.
[PubMed] - 25.
Papich MG. Selection of antibiotics for meticillin-resistant Staphylococcus pseudintermedius: time to revisit some old drugs? Vet Dermatol 2012; 23(4): 352-360, e64.
[PubMed] - 26.
Akutsu S, Samura K, Shimamura T, et al. Toxicological study of amikacin following intravenous drip infusion. 2. Subacute toxicity in dogs after intravenous injection. Jpn J Antibiot 1982; 35(8): 2069-2099.
[PubMed] - 27.
Lehner G, Linek M, Bond R, et al. Case–control risk factor study of methicillin-resistant Staphylococcus pseudintermedius (MRSP) infection in dogs and cats in Germany. Vet Microbiol 2014; 168(1): 154-160.
[PubMed] - 28.
Loeffler A, Beever L, Chang YM, et al. Intervention with impact: Reduced isolation of methicillin-resistant Staphylococcus pseudintermedius from dogs following the introduction of antimicrobial prescribing legislation in Germany. Vet Rec 2023; e3714.
[PubMed] - 29.
Hensel N, Zabel S, Hensel P. Prior antibacterial drug exposure in dogs with meticillin-resistant Staphylococcus pseudintermedius (MRSP) pyoderma. Vet Dermatol 2016; 27(2): 72-e20.
[PubMed]